Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)

Đáp án D
Các phương trình phản ứng:
Hỗn hợp kim loại tác dụng với oxi:
Au, Ag không tác dụng với oxi
![]()
Phương trình phản ứng :
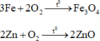
Rắn X gồm Au, Ag, CuO, Fe3O4 và ZnO tác dụng với dung dịch H2SO4 loãng:
Au, Ag không tác dụng với dung dịch H2SO4 loãng
![]()
Phương trình phản ứng
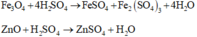
Tính toán:
Gọi M là kim loại chung cho Cu, Fe và Zn với hóa trị n
Sơ đồ phản ứng :
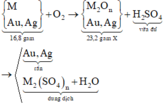
Bảo toàn khối lượng cho giai đoạn hỗn hợp kim loại tác dụng với oxi:
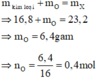
Theo sơ đồ thì cuối cùng O chuyển hết về O trong H2O. Bảo toàn nguyên tố O ta có:
n H 2 O = n O ⇒ n H 2 O = 0 , 4 mol
Bảo toàn nguyên tố H ta có:
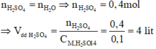

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.

a)
Fe + S --to--> FeS
Fe + 2HCl --> FeCl2 + H2
FeS + 2HCl --> FeCl2 + H2S
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\); \(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\) => Fe hết, S dư
=> Chất sau khi nung gồm FeS, S dư
b)
PTHH: Fe + S --to--> FeS
0,1->0,1------->0,1
FeS + 2HCl --> FeCl2 + H2S
0,1-------------------->0,1
=> Y là H2S
VH2S = 0,1.22,4 = 2,24 (l)
c) Z là S
mS = (0,15 - 0,1).32 = 1,6 (g)

Câu 1 :
n Mg = 4,8/24 =0,2(mol)
n H2 = 3,36/22,4 = 0,15(mol)
Y gồm 0,2 mol Mg và O
Bảo toàn electron :
2n Mg = 2n O + 2n H2
<=> n O = 0,2 - 0,15 = 0,05(mol)
\(2H^+ + O^{2-} \to H_2O\\ 2H^+ + 2e \to H_2\)
Ta có :
n H+ = 2n O + 2n H2 = 0,15.2 + 0,05.2 = 0,4(mol)
=> n H2SO4 = 1/2 nH+ = 0,2(mol)
=> V dd H2SO4 = 0,2/1 = 0,2(lít)
Câu 2 :
Oleum : H2SO4.nSO3
n NaOH = 0,2.0,15 = 0,03(mol)
2NaOH + H2SO4 $\to$ Na2SO4 + 2H2O
n H2SO4 = 1/2 n NaOH = 0,015(mol)
=> trong 200 ml dung dịch X chứa 0,015.2 = 0,03(mol) H2SO4
H2SO4.nSO3 + nH2O $\to$ (n + 1)H2SO4
Theo PTHH :
\(n_{oleum} = \dfrac{n_{H_2SO_4}}{n + 1}\\ \Rightarrow 0,015 = \dfrac{0,03}{n + 1}\\ \Rightarrow n = 1\)
Vậy oleum cần tìm là H2SO4.SO3
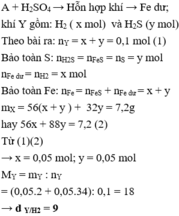

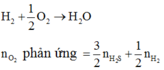
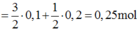


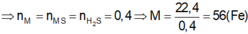
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\)
PTHH: Mg + S -to-> MgS
Xét tỉ lệ \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\) => Mg dư, S hết
PTHH: Mg + S -to-> MgS
0,1<-0,1--->0,1
=> \(\left\{{}\begin{matrix}n_{Mg\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\\n_{MgS}=0,1\left(mol\right)\end{matrix}\right.\)
PTHH: MgS + H2SO4 --> MgSO4 + H2S
0,1-------------------------->0,1
Mg + H2SO4 --> MgSO4 + H2
0,1------------------------->0,1
=> \(\overline{M}_B=\dfrac{0,1.34+0,1.2}{0,1+0,1}=18\left(g/mol\right)\)
=> \(d_{B/He}=\dfrac{18}{4}=4,5\)