Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
Vì phản ứng tạo m gam hỗn hợp rắn D => D có Ag và Cu. Giả sử Cu2+ còn dư x mol
A( 0,15 mol Mg2+ ; 0,1 mol Fe2+ và x mol Cu2+) + NaOH -> Mg(OH)2 ; Fe(OH)2 ; Cu(OH)2
Nhiệt phân : 0,15 mol MgO ; 0,05 mol Fe2O3 và x mol CuO
=> mE = 0,15.40 + 0,05.160 + 80x = 18
=> x = 0,05 mol
Bảo toàn điện tích : nAg+ + 2nCu2+ pứ = 2nMg + 2nFe
=> a + 2(a – 0,05) = 0,15.2 + 0,1.2
=> a = 0,2
=> D gồm : 0,2 mol Ag và 0,15 mol Cu
=> m = 31,2g

Chọn đáp án A
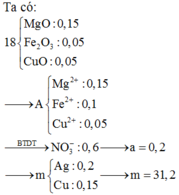
n M g = 0 , 15 mol; n Fe = 0 , 1 mol. Ta thấy nếu phản ứng xảy ra vừa đủ thì:
m E = m MgO + m Fe 2 O 3 = 0 , 15 x 40 + 0 , 1 ÷ 2 x 160 = 14 gam < 18 gam.
⇒ A chứa Cu2+ dư ⇒ m CuO = 18 - 14 = 4 gam ⇒ n Cu 2 + dư = n CuO = 0 , 05 mol.
A chứa Mg2+, Fe2+, Cu2+, N O 3 - . Bảo toàn điện tích: n NO 3 - = 0 , 6 mol.
⇒ a + 2 a = 0 , 6 ⇒ a = 0 , 2 mol ⇒ B gồm 0,2 mol Ag và (0,2 – 0,05 = 0,15) mol Cu.
⇒ m = 0,2 × 108 + 0,15 × 64 = 31,2 gam

Đáp án A
Đặt n NO = a mol ; n NO2 = b mol
=> a+ b = 2,2 mol
30a + 46b = 85,2
=>a = 1 mol ; b = 1,2 mol
Qui đổi X về thành hỗn hợp có x mol Fe và y mol S
=> Quá trình cho nhận e khi phản ứng với HNO3
+ Cho e : Fe → Fe+3 + 3e
S → S+6 + 6e
+ Nhận e: N+5 → N+2 +3e
N+5 → N+4 + 1e
=> n e trao đổi = 3x + 6y = 4,2 (1)
Khi cho Ba(OH)2 váo Y tạo kết tủa rồi nung thu được BaSO4 và Fe2O3
Theo định luật bảo toàn có n BaSO4 = nS = y mol ; nFe2O3 = 0,5nFe = 0,5x mol
=> m rắn = 80x+ 233y =148,5 (2)
Từ 1 và 2 ta có x = 0,4 mol ; y = 0,5 mol
=> m =56.0,4 + 32.0,5 =38,4 g
=>A
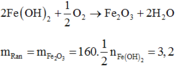
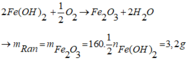

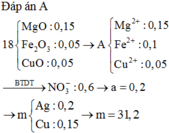
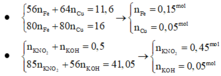
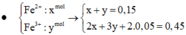
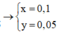
Đáp án : C
2Fe(OH)2 + ½ O2 -> Fe2O3 + 2H2O
=> mrắn = mFe2O3 = 160. ½ nFe(OH)2 = 3,2g