Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1 :
Ta có sơ đồ: \(A\underrightarrow{^{to}}B+O_2\)
\(n_{O2}=\frac{1,68}{22,4}=0,075\left(mol\right)\rightarrow m_{O2}=0,075.32=2,4\left(g\right)\)
Theo định luật bảo toàn khối lượng ta có:
mA = mB + m oxi → mB = mA - moxi
\(=15,15-2,4=12,75\left(g\right)\)
Trong B: \(m_O=12,75.37,65\%=4,8\left(g\right)\)
\(m_N=12,75.16,47\%=2,1\left(g\right)\)
\(m_K=12,75-\left(4,8+2,1\right)=5,84\left(g\right)\)
Suy ra :
\(n_O=\frac{4,8}{16}=0,3\left(mol\right)\)
\(m_N=\frac{2,1}{14}=0,15\left(mol\right)\)
\(n_K=\frac{5,85}{39}=0,15\left(mol\right)\)
Gọi CTHH của B là KxNyOz
Ta có \(x:y:z=n_K:n_N:n_O=0,15:0,15:0,3=1:1:2\)
Chọn x = 1, y = 1, z = 2 → Công thức đơn giản nhất là KNO2
Theo gt \(\rightarrow\) CTHH của B là KNO2.
Trong A: theo định luật bảo toàn nguyên tố:
\(m_O=4,8+2,4=7,2\left(g\right)\)
\(n_O=\frac{7,2}{16}=0,45\left(mol\right)\)
\(n_N=0,15\left(mol\right),n_K=0,15\left(mol\right)\)
Gọi CTHH của A là KaNbOc
Ta có\(a:b:c=0,15:0,15:0,45=1:1:3\)
Chọn a = 1, b = 1, c =3
Vậy CTHH là : \(KNO_3\)
Bài 2:
Gọi CTPT là CxHyOz
\(n_{CO2}=n_{CaCO3}=\frac{40.}{100}=0,4\left(mol\right)\)
\(m_{H2O}=26,6-0,4.44\)
\(\rightarrow n_{H2O}=0,5\)
\(n_{O2}=0,6\)
\(m_A=26,6-0,6.32=7,4\)
\(M_A=37.2=74\)
\(\rightarrow n_A=0,1\)
\(n_C=0,4\)
\(n_H=0,5.2=1\)
\(n_O=0,4.2+0,5-0,6.2\left(bt.O\right)=0,1\)
Có \(x:y:z=0,4::0,1=4:10:1\)
Vậy A là C4H10O

Cau 1 :
\(n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,1 0,1
a) Chat trong dung dich A thu duoc la : sat (II) clorua
Chat ran B la : dong
Chat khi C la : khi hidro
b) \(n_{Fe}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(m_{Fe}=0,1.56=5,6\left(g\right)\)
\(m_{Cu}=10-5,6=4,4\left(g\right)\)
0/0Fe = \(\dfrac{5,6.100}{10}=56\)0/0
0/0Cu = \(\dfrac{4,4.100}{10}=44\)0/0
c) Co : \(m_{Cu}=4,4\left(g\right)\)
\(n_{Cu}=\dfrac{4,4}{64}=0,06875\left(mol\right)\)
Pt : \(Cu+2H_2SO_{4dac}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O|\)
1 2 1 1 2
0,06875 0,06875
\(n_{SO2}=\dfrac{0,06875.1}{1}=0,06875\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=1,54\left(l\right)\)
Chuc ban hoc tot
Minh xin loi ban nhe , ban bo sung vao cho :
\(V_{SO2\left(dktc\right)}=0,06875.22,4=1,54\left(l\right)\)

Cho hỗn hợp X vào H2SO4 thu được (a+b)g --> hh X gồm oxit kim loại A và kim loại B
Trong đó: oxit kim loại A ko bị khử bởi CO, kim loại B ko tan trong d.d H2SO4
-->Dễ suy ra kim loại B là Cu
(*)Giả sử oxit kim loại A là AO
AO+H2SO4-->ASO4+H2O
1..........1..........1 mol
m d.d sau pư=A+16+980=A+996 g
C% ASO4=11,765%
\(\Rightarrow\frac{A+96}{A+996}=0,11765\)
\(\Rightarrow A=24\left(Mg\right)\)
(*) Giả sử là A2O3 làm tương tự -->loại
Nếu ko chia trường hợp thì gọi là A2Ox hoặc AxOy

Ta có: \(n_K=\dfrac{1,56}{39}=0,04\left(mol\right)\)
\(m_{CuSO_4}=200.8\%=16\left(g\right)\Rightarrow n_{CuSO_4}=\dfrac{16}{160}=0,1\left(mol\right)\)
PT: \(2K+2H_2O\rightarrow2KOH+H_2\)
___0,04___________0,04___0,02 (mol)
\(2KOH+CuSO_4\rightarrow K_2SO_4+Cu\left(OH\right)_{2\downarrow}\)
Xét tỉ lệ: \(\dfrac{0,04}{2}< \dfrac{0,1}{1}\), ta được CuSO4 dư.
Theo PT: \(n_{Cu\left(OH\right)_2}=n_{CuSO_4\left(pư\right)}=n_{K_2SO_4}=\dfrac{1}{2}n_{KOH}=0,02\left(mol\right)\)
⇒ nCuSO4 (dư) = 0,08 (mol)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
___0,02____0,02 (mol)
a, Ta có: VB = 0,02.22,4 = 0,448 (l)
b, mCuO = 0,02.80 = 1,6 (g)
c, Ta có: m dd sau pư = 1,56 + 200 - 0,02.2 - 0,02.98 = 199,56 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{K_2SO_4}=\dfrac{0,02.174}{199,56}.100\%\approx1,74\%\\C\%_{CuSO_4\left(dư\right)}=\dfrac{0,08.160}{199,56}.100\%\approx6,41\%\end{matrix}\right.\)
Bạn tham khảo nhé!
\(n_K=\dfrac{1,56}{39}=0,04\left(mol\right)\)
\(n_{CuSO4}=\dfrac{200.8}{100.160}=0,1\left(mol\right)\)
\(2K+2H2O\rightarrow2KOH+H2\)
0,04--------------->0,04------------->0,02(mol)
\(2KOH+CuSO4\rightarrow Cu\left(OH\right)2+K2SO4\)
0,04-------->0,02----->0,02------->0,02(mol)
=> dd A gồm CuSO4 dư và K2SO4
=> Khí B là H2
=>Kết tủa C là Cu(OH)2
a) \(V_{H2}=0,02.22,4=0,448\left(l\right)\)
b)\(Cu\left(OH\right)2\rightarrow CuO+H2O\)
0,02---------------->0,02(mol)
\(m_{CuO}=0,02.80=1,6\left(g\right)\)
c) \(m_{KOH}=0,04.56=2,24\left(g\right)\)
\(m_{Cu\left(OH\right)2}=0,02.98=1,96\left(g\right)\)
\(\Rightarrow\)\(m_{dd}=200+2,24-1,96=200,28\left(g\right)\)
\(C\%_{K2SO4}=\dfrac{0,02.174}{200,28}.100\%=1,74\%\)
\(n_{CuSO4}dư=0,1-0,02=0,08\left(mol\right)\)
\(C\%_{CuSO4}=\dfrac{0,08.160}{200,28}.100\%=6,39\%\)
Chúc bạn học tốt^^

a) Nhận xét: 33,84g X > 16g rắn → kim loại còn dư.
Chú ý: sau một thời gian ám chỉ các chất tham gia đều dư.
Giả sử số mol của Mg, Fe lần lượt là x, y
Tăng giảm khối lượng: (64 – 24) . x + (64 – 56) . y = 38,24 – 33,84 (1)
Chất rắn bao gồm MgO: x; Fe2O3: 0,5y; CuO: a – x – y
=> 40x + 160 . 0,5y + 80(a – x – y) = 16 (2)
Từ (1) và (2) => 10a + y = 2,55
amax <=> y = 0 => amax = 0,255
b) giá trị a đạt max thì Fe chưa tham gia pứ.
Giả sử số mol Mg dư là: z (mol) 19,12g Z cho 0,48 mol SO2 → 38,24g Z cho 0,96 mol SO2
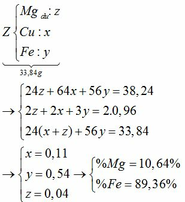

Phản ứng nhiệt nhôm:
2 A l + F e 2 O 3 → t 0 A l 2 O 3 + 2 F e ( 1 )
Phần 1 tác dụng với dung dịch NaOH dư không sinh ra khí → hỗn hợp B không có Al dư. Vậy hỗn hợp B gồm A l 2 O 3 , Fe và có thể có F e 2 O 3 dư.
4,4 gam chất rắn không tan có thể gồm Fe và F e 2 O 3 d ư
Phần 2: tác dụng với H 2 S O 4 loãng dư → chỉ có Fe phản ứng sinh ra khí
n H 2 = 1,12 22,4 = 0,05
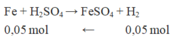
Khối lượng F e 2 O 3 dư ở phần 2 = 4,4 – mFe = 4,4 – 0,05.56 = 1,6 gam.
n F e 2 O 3 p u b d đ = 2. 1 2 . n F e ( p 2 ) = 0,05 m o l
Khối lượng F e 2 O 3 ban đầu: 0,05.160 + 1,6.2 = 11,2 gam.
⇒ Chọn B.

Có: nH2SO4 \(=\frac{4,9}{98}=0,05\left(mol\right)\)
Vì: \(x_1+H2S\text{O4}\rightarrow X_2+X_3\) nên X1 có thể là: oxit bazo, oxit lưỡng tính, bazo, hidroxit lưỡng tính, muối. Nhưng vì bài cho X1 có thể là CaO,MgO,NaOH,KOH,Zn và Fe nên loại các trường hợp oxit lưỡng tính, hidroxit lưỡng tính, muối.
TH1: X1 là oxit bazo: CaO,MgO.
Gọi CTPT chung cho X1 là MgO.
PTPU:
MO + H2SO4 → MSO4 + H2O (*) mol
0,05 0,05 0,05
Vậy KL mol của MO là: \(M_{MO}=\frac{2,8}{0,05}=56\left(g\right)\)
Vậy MO là CaO
TH2: Xét X1 là bazo: NaOH, KOH
Gọi CTPT chung cho X1 là MOH.
PTPƯ: 2MOH + H2SO4 → M2SO4 + 2H2SO4 (**)
0,1 0,05 0,05
Vậy KL mol của MOH là: \(M_{MOH}=\frac{2,8}{0,1}=28\left(g\right)\) (không có MOH thỏa mản)
TH3: X1 kim loại Zn và Fe. Gọi CTCP chung cho X1 là M.
PTPU: M + H2SO4 → MSO4 + H2 (***)
0,05 0,05 0,05
Vậy KL mol MO là \(M_M=\frac{2,8}{0,05}=56\left(g\right)\). Vậy M là Fe.
b. X1 là CaO thì X2 là \(m_{CaS\text{O4}}=0,05.136=6,8\left(g\right)\)
(khác bài ra 7,6 g) loại.
X1 là kim loại Fe thì X2 \(m_{FeS\text{O4}}=0,05.152=7,6\left(g\right)\) phù hợp với đề bài như vậy X3 là H2

2Al + 3S —> Al2S3
Chất rắn X gồm Al2S3, Al dư và S dư. Khí gồm H2S và H2. Chất rắn không tan là S dư.
+)Khí với Pb(NO3)2:
H2S + Pb(NO3)2 —> PbS + 2HNO3
0,03………………..……….0,03
n khí = 0,06 —> nH2 = 0,06 – 0,03 = 0,03 (mol)
+) Chất rắn X với HCl dư:
Al2S3 + 6HCl —> 2AlCl3 + 3H2S
0,01…………….....................0,03
2Al + 6HCl —> 2AlCl3 + 3H2
0,02………………………….0,03
+) Nung Al với S:
2Al + 3S —> Al2S3
0,02…0,03…..0,01
mAl = (0,02 + 0,02).27 = 1,08 g
mS = 0,03.32 + 0,04 = 1 g
mk nghĩ đề là 16,47%N
PTHH: A--to--> B+O2
- Gọi CTHH của B là \(K_xN_yO_z\left(K,N,O\ne0\right)\)
=> %K = 100% - %O - %N = 100% - 37,65% - 16,47% = 45,88%
\(x:y:z=\dfrac{45,88\%}{39}:\dfrac{16,47\%}{14}:\dfrac{37,65\%}{16}=1:1:2\)
=> CTHH của B là KNO2
n\(O_2\) = \(\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
=> m\(O_2\) = 0,075 . 32 = 2,4(g)
=> mB = mA- m\(O_2\) = 15,15 - 2,4 = 12,75 (g)
=> mB = m\(KNO_2\)= 12,75(g)
=> n\(KNO_2\) = \(\dfrac{12,75}{85}=0,15\left(mol\right)\)
=> Trong hợp chất A có K, N, O
- Gọi CTHH của A là KaNbOt (a,b,t\(\ne\)0)
Theo bài ra: nK(trong A) = nK(hcKNO2)= 0,15 (mol)
=> nN(A)= nN(hcKNO2) = 0,15 (mol)
=> nO(A) = nO(hcKNO2) + nO(O2) = 2.0,15 + 2.0,075 = 0,45 (mol)
=> a:b:t= nK : nN : nO = 0,15:0,15:0,45 = 1:1:3
=> CTHH của A là KNO3