Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
Gọi CT chung của 2 muối cacbonat kim loại hóa trị II là RCO3
RCO3 → (đk :t0) RO + CO2
Áp dụng định luật bảo toàn khối lượng ta có :
m CO2 = m RCO3 - mRO = 13,4 – 6,8 = 6,6 g
=> n CO2 = 0,15 mol
Ta có :
n NaOH = 0,075 mol
=> k = n NaOH / nCO2 = 0,075 / 0,15 = 0,5 < 1
=> Tạo muối NaHCO3 và CO2 dư
CO2 + NaOH → NaHCO3
0,075 0,075
=> mmuối = 0,075. 84 = 6,3 g

mCO2 = 13.4 - 6.8 = 6.6 > nCO2 = 0.15mol.
nNaOH = 0.075 mol > nCO2 = 2nNaOH > muối NaHCO3 với m = 6.3g

Đáp án D
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=>3x + 6z = 2y + 0,15 + 0,1 + 8t(1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=>t + 3x = 2z(2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13(3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=>1,36 = 32z – 16.(1,5x – y)(4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g

Giải thích:
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=> 3x + 6z = 2y + 0,15 + 0,1 + 8t (1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=> t + 3x = 2z (2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13 (3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=> 1,36 = 32z – 16.(1,5x – y) (4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g
Đáp án D

Đáp án B
Trong T có KNO3
KN O 3 → t 0 KN O 2 + 0,5 O 2
Nếu trong T không có KOH, vậy khối lượng chất rắn thu được sau khi nhiệt phân T là khối lượng của KNO2.
mKNO2 = 0,5. 85 = 42,5 > 41,05
=> T gồm KOH dư và KNO2
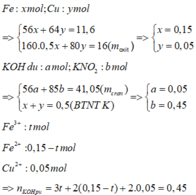

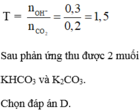
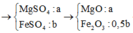
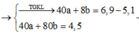
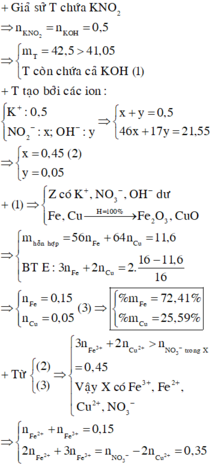
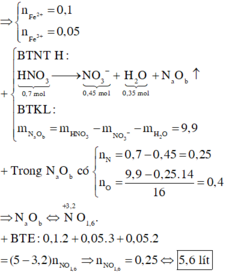
Khí X là CO2
Áp dụng định luật bảo toàn khối lượng: 14,2 = 7,6 + mx => mx = 6,6 gam =>nx = 0,15 mol
Vì nKOH : nCO2 = 0,1: 0,15 <1 => muối thu được là KHCO3
CO2 + KOH = KHCO3
Vậy m KHCO3 = 0,1.100 = 10 gam.