Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Hướng dẫn
Gọi n là số nhóm NO2 trung bình trong 2 hợp chất nitro.
Ta có CTPT tương đương của hai hợp chất nitro là C6H6 - n(NO2)n
C6H6 - n(NO2)n → n/2 N2
Ta có:
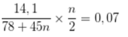
→ n = 1,4 → n = 1 và n = 2
=> C6H5NO2 và C6H4(NO2)2

Đáp án A
Hướng dẫn Đặt CTPT chung của 2 hợp chất là C6H6-n(NO2)n
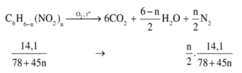
Ta có
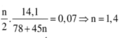
Hỗn hợp 2 chất nitro có khối lượng phân tử hơn kém nhau 45dvc nên phân tử của chúng hơn kém nhau 1 nhóm –NO2.
=> C6H5NO2 và C6H4(NO2)2.

Đáp án A
Đặt công thức phân tử trung bình của 2 hợp chất nitro là ![]() .
.
Phản ứng cháy:
![]()
![]()
![]()
Từ giả thiết có:
![]()
2 hợp chất nitro có M hơn kém nhau 45đvC suy ra phân tử hơn kém nhan 1 nhóm -NO2
Suy ra 2 chất đó là C6H5NO2 và C6H4(NO2)2

Đáp án B
Hướng dẫn nN2 = 0,055 mol => nhh = 0,11/ n ¯ => M = 116 => n ¯ = 1,1 = CTPT của X: C6H5NO2. Ta có: nX: nY = 9:1 => nX = 0,09 mol

Trong trường hợp này, X đã “bão hòa”, không thể cho e được nữa, nhưng nó đã được CO lấy đi một lượng O để phá vỡ trạng thái này. CO + [O] →CO2
Và thế là X trở thành Y, lại có thể cho e với N+5 tạo thành NO, NO2.
Theo lý thuyết, nếu HNO3 lại đưa Y lên trạng thái bão hòa thì số mol e mà N+5 nhận được là 0,24 x 2 = 0,48 mol
Nhưng trên thực tế, con số này là 0,11 x 3 + 0,07 x 1= 0,40 mol
Sở dĩ điều này xảy ra là do có một lượng Fe chỉ tồn tại ở số oxi hóa +2
→ nFe2+ = 0,48 – 0,40 =0,08 → mFe(NO3)2 = 14,4 gam
Chọn đáp án C

Có : nFe = nAl = nMg = 0,12 mol
Y : N2 ; N2O ; NO và NO2( N2 và NO2 có số mol bằng nhau)
=> Qui đổi : NO2 +N2 -> NO + N2O
=> Y trở thành : NO và N2O với số mol lần lượt là x và y.
Có : MY = 37g => mY = 37(x + y) = 30x + 44y
=> x = y(1)
Giả sử có z mol NH4NO3 trong muối
Bảo toàn e : 3nFe + 3nAl + 2nMg = 3nNO + 8nN2O + 8nNH4NO3
=> 3x + 8y + 8z = 0,96 mol(2)
Và : nHNO3 = (4x + 10y + 10z)
=> nH2O = ½ (nHNO3 – 4nNH4NO3) = (2x + 5y + 3z) mol
Bảo toàn khối lượng :
mY = mKL + mHNO3 – mH2O - mmuối X = (216x + 540y + 576z) – 62,52 = 37(x + y)
=> 179x + 503y + 576z = 62,52(3)
Từ (1),(2),(3) => x = y = 0,06 ; z = 0,0375 mol
=> nHNO3 pứ = 4x + 10y + 10z = 1,215 mol
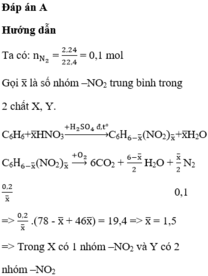

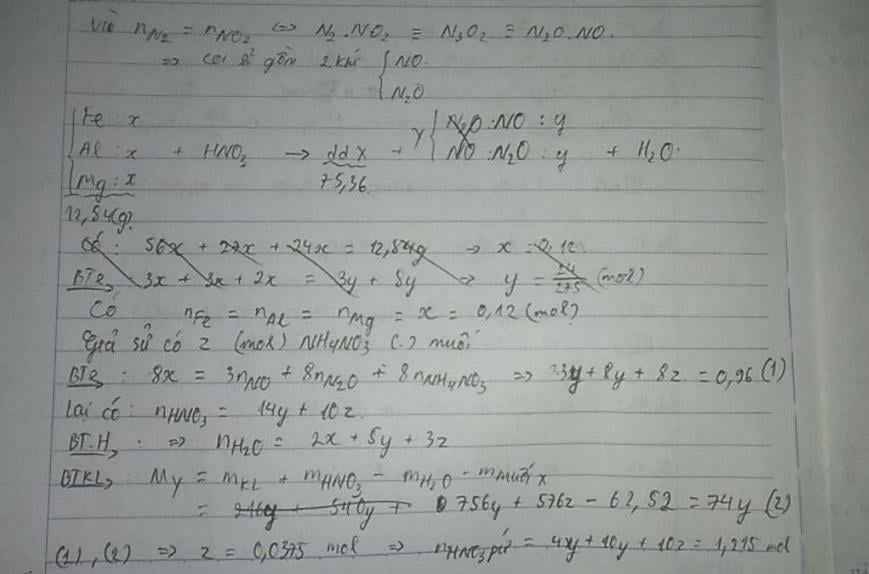
Đáp án A
Gọi n là số nhóm NO2 trung bình trong 2 hợp chất nitro.
Ta có CTPT tương đương của hai hợp chất nitro là C6H6 - n(NO2)n
C6H6 - n(NO2)n → n/2 N2
Ta có 14 , 1 78 + 45 n . n 2 = 0 , 07
→ n = 1,4 → n = 1 và n = 2