

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




Chọn đáp án C
Tổng nH+ = 0,02 + 0,06 = 0,08 mà có n H C O 3 - = 0,03 và n H C O 3 2 - = 0,06 Þ Tỉ lệ 1: 2
Đặt số mol n H C O 3 - phản ứng = x Þ n H C O 3 2 - phản ứng = 2x Þ x + 2.2x = 0,08
Þ x = 0,08/5 = 0,016
Þ nCO2 = x + 2x = 3x0,016 = 0,048 Þ V = 0,048x22,4 = 1,0752
X lúc này có n S O 4 2 - = 0,06, n B a 2 + = 0,03 - 0,016 = 0,014; n C O 3 2 - = 0,06 - 0,032 = 0,028
Thêm vào X hỗn hợp 0,06 OH- và 0,15 Ba2+ Þ nOH- > n H C O 3 -
Þ Sau phản ứng với OH-, tổng n B a 2 + = 0,014 + 0,028 = 0,042
Vì 0,042 + 0,06 <0,15 Þ Ba2+ dư Þ nBaCO3 = 0,042 và nBaSO4 = 0,06
Vậy m = 0,042x197 + 0,06x233 = 22,254

Chọn C.
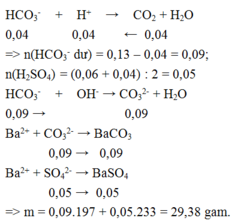
Khi cho từ từ X vào KHSO4 thì:
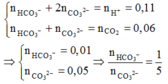
Khi Y tác dụng với Ba(OH)2 dư thì kết tủa thu được là
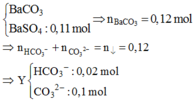
Vậy trong X có KHCO3 (0,03 mol) và Na2CO3 (0,15 mol) Þ m = 18,9 (g)