Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

| 2Zn(NO3)2 |
→ |
2ZnO |
+ |
4NO2 |
+ |
O2 |
b b 2b b/2
khối lượng chất rắn giảm đi 2,7gam ⇒ mNO2 + mO2 = 2,7g
⇒ 46.2b + 32.b/2 = 2,7 ⇒ b = 0,025
n Zn(NO3)2 ban đầu = 0,025.189 : 60%=7,875g
Đáp án C.

Đáp án C
NH4NO2 → N2+ 2H2O
x x 2x mol
mchất rắn giảm= mN2+ mH2O= 28x + 2. 18x= 32-10= 22
→ x= 0,34375 mol
→ H= nNH4NO2 pứ/ nNH4NO2 ban đầu= x/0,5.100%= 68,75%

Đáp án B
(NH4)2Cr2O7 → Cr2O3+ N2 + 4H2O
x mol x x 4x mol
mchất rắn giảm= mN2+ mH2O= 28x + 18.4x= 32-20
→ x= 0,12 mol; n(NH4)2Cr2O7 ban đầu=8/63 mol
H = npứ/ nban đầu. 100%= 94,5%

Đáp án D
Nhận thấy cả 4 kim loại tương ứng với 4 đáp án đều là trường hợp nhiệt phân muối nitrat tạo oxit kim loại. Khối lượng chất rắn giảm khi đó là khối lượng của hỗn hợp khí gồm NO2 và O2.
Có hai trường hợp xảy ra:
+) Hóa trị của M trong oxit sản phẩm và trong muối là như nhau. Khi đó:

+) Hóa trị của M trong oxit sản phẩm và trong muối khác nhau. Tuy nhiên vì đã tìm ra được kim loại trùng với 1 trong 4 đáp án ở trường hợp trên nên các bạn không cần giải tiếp trường hợp này.

Đáp án B
Khi nhiệt phân hoàn toàn Fe(NO3)2, sản phẩm thu được cuối cùng là Fe2O3.
Áp dụng định luật bảo toàn nguyên tố, ta có:
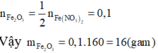

\(2Cu\left(NO_3\right)_2\underrightarrow{t^o}2CuO+4NO_2+O_2\)
\(\dfrac{m}{188}\)-----------\(\dfrac{m-1,08}{80}\)
\(\dfrac{m}{188}\)=\(\dfrac{m-1,08}{80}\)\(\Rightarrow\)m=1,08(g)

\(n_{NH_4NO_2}=\dfrac{80}{64}=1.25\left(mol\right)\)
=> \(n_{NH_4NO_3\left(pư\right)}=\dfrac{1,25.75}{100}=0,9375\left(mol\right)\)
PTHH: NH4NO2 -to-> N2 + 2H2O
_____0,9375------>0,9375
=> VN2 = 0,9375.22,4 = 21(l)

CaCO3 \(\rightarrow\) CaO + CO2
BTKL : mCO2 = m - 0,78m = 0,22 m
Từ pt: \(\frac{mCaCO3}{mCO2}\) = \(\frac{100}{44}\) \(\rightarrow\) mCaCO3pứ = 0,5m
H= 80%
\(\rightarrow\) mCaCO3thựctế =\(\frac{0,5}{80}\).100 = 0,625m
\(\rightarrow\)a =\(\frac{0,625}{1}\) .100 = 62.5%
Đáp án B