Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left\{{}\begin{matrix}2Z+N=52\\2Z-N=16\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}Z=17\\N=18\end{matrix}\right.\)
p=e=17
n=18
Cấu hình là: \(1s^22s^22p^63s^23p^5\)

1. Ta có tổng số hạt cơ bản của nguyên tố X là 36 , suy ra
p + e + n = 36 => 2p + n = 36
Số hạt mang điện gấp đôi số hạt không mang điện : 2p = 2n => p = n
Vậy : 3p = 36 => p = 12 => số p = số e = số z = 12
Số khối : A = p + n = 12 + 12 = 24
2.
a, Ta có tổng số hạt cơ bản là 54 hạt.
=> p+e+n=54 => 2p+n=54(1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 14
=> 2p-n=14(2)
Từ (1) và (2) ta có hệ pt:
2p-n=14
2p+n=54
<=> p=17
n=20
Vậy e=17, p=17, n=20
b, số hiệu nguyên tử Z=17
c, kí hiệu: Cl

a, Ta có: P + N + E = 34
Mà: P = E (Do nguyên tử trung hòa về điện.)
⇒ 2P + N = 34 (1)
Theo đề, số hạt mang điện nhiều hơn số hạt không mang điện là 10.
⇒ 2P - N = 10 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}P=E=11=Z\\N=12\end{matrix}\right.\) ⇒ A = 11 + 12 = 23
→ KH: \(^{23}_{11}X\)
b, Cấu hình e: 1s22s22p63s1
Cấu hình e theo orbital:
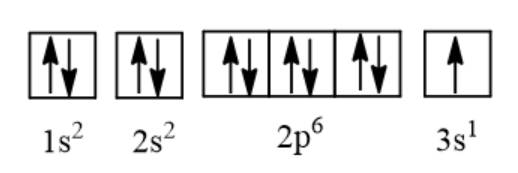
c, X có 1 e hóa trị → tính kim loại
d, - Z = 11 → ô số 11
- Có 3 lớp e → chu kỳ 3
- e cuối cùng phân bố ở phân lớp s, có 1 e hóa trị → nhóm IA
Vậy: X thuộc ô số 11, chu kỳ 3, nhóm IA

\(\begin{cases} 2Z_A+n_A=34\\ 2Z_A-n_A=10 \end{cases} ⇒ \begin{cases} Z_A=11 (Na)\\ n_A=12 \end{cases} \)
\(Z_A-Z_B=2 ⇒ Z_B=9 (F)\)
\(⇒\) Vậy hợp chất AB là NaF, thuộc loại liên kết ion, do Na, F lần lượt là kim loại và phi kim điểm hình.

Gọi :
Số hạt proton = Số hạt electron = p
Số hạt notron = n
Ta có :
- Tổng số hạt :2p + n = 34 (1)
- Trong hạt nhân(gồm hai loại hạt : proton và notron) ,hạt không mang điện nhiều hơn mang điện là 1 : n - p = 1(2)
Từ (1)(2) suy ra p = 11 ; n = 12
a) Kí hiệu : Na ( Natri)
b) Cấu hình electron :1s22s22p63s1
X có 1 electron ở lớp ngoài cùng (3s1) nên X là kim loại.

