Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
- Phần trăm của đồng vị còn lại là 100% - 54,5% = 45,5%
- Công thức tính nguyên tử khối trung bình:
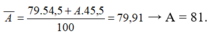

Đặt x nguyên tử khối của đồng vị còn lại
Ta có : \(\overline{M}=\dfrac{54,5.79+\left(100-54,5\right).x}{100}=79,91\)
\(\rightarrow x=81\)
Vậy nguyên tử khối của đồng vị còn lại : \(^{81}X\)

- Đồng vị thứ nhất có:A1=35+44=79
- Đồng vị thứ 2 có: A2=79+2=81
\(\overline{A}=\dfrac{27.79+23.81}{27+23}=79,92\)

a) Hạt nhân đồng vị thứ nhất có 35p và 44n => A1= Z+N = 79
=> \(^{79}_{35}Br\)
Đồng vị thứ hai hơn đồng vị thứ nhất là 2n => A2 = A1 +2 =81
=> \(^{81}_{35}Br\)
Gọi phần trăm của đồng vị thứ nhất là x %
Ta có : \(\overline{M}=\dfrac{79.x+81.\left(100-x\right)}{100}=79,92\)
=> x=54
Vậy phần trăm số nguyên tử đồng vị thứ nhất là 54%, phần trăm số nguyên tử đồng vị thứ hai là 46%
b) Trong 1 mol nguyên tử Br có : \(n_{^{79}_{35}Br}=54\%.1=0,54\left(mol\right)\)
\(n_{^{81}_{35}Br}=1-0,54=0,46\left(mol\right)\)
\(\%m_{^{79}_{35}Br}=\dfrac{0,54.79}{79,92}=53,38\%\)
\(\%m_{^{81}_{35}Br}=\dfrac{0,46.81}{79,92}=46,62\%\)
c) Trong 1 mol Brom thì có : \(n_{^{79}_{35}Br}=54\%.1=0,54\left(mol\right)\)
=> Số nguyên tử có trong \(^{79}_{35}Br\) là : \(0,54.6.10^{23}=3,24.10^{23}\) (nguyên tử)
\(n_{^{81}_{35}Br}=1-0,54=0,46\left(mol\right)\)
=> Số nguyên tử có trong \(^{81}_{35}Br\) là : \(0,46.6.10^{23}=2,76.10^{23}\) (nguyên tử)

Đáp án A
Khối lượng nguyên tử trung bình của Br là
MBr = ( 79 . 54 , 5 + 81 ( 100 - 54 , 5 ) ) / 100 = 79 , 91
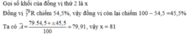
Nguyên tử khối trung bình:
\(79.54,5\%+A\left(100\%-54,5\%\right)=79,91\)
\(\Rightarrow A=81\)