Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Br thuộc nhóm VIIA, chu kì 4 có 35 electron nên cấu hình theo lớp electron là 2, 8, 18, 7. Nó có 7e lớp ngoài cùng nên là phi kim. Hóa trị cao nhất với oxi là VII. Hóa trị trong hợp chất khí với hiđro là I và có công thức phân tử là HBr.
b) Tính phi kim giảm dần Cl, Br, I.

a) Cấu hình electron của nguyên tử Mg: 1s22s22p63s2.
Mg có 2e ở lớp ngoài cùng nên thể hiện tính kim loại, hóa trị cao nhất với oxi là II, chất MgO là oxit bazơ và Mg(OH)2 là bazơ.
b) Na:1s22s22p63s1.
Mg: 1s22s22p63s2
Al: 1s22s22p63s23p1
- Có 1, 2, 3 electron ở lớp ngoài cùng nên đều là kim loại.
- Tính kim loại giảm dần theo chiều Na, Mg, Al.
- Tính bazơ giảm dần theo chiều NaOH, Mg(OH)2, Al(OH)3.

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.

Số oxi hóa của nitơ trong NH4+ , NO-2 , và HNO3 lần lượt là:
A. +5, -3, +3.
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3.

Các bạn ơi giúp mình với. Chuyên đề này sáng mai mình phải nộp rồi! Cảm ơn các bạn nhiều!

Chọn D
Gọi hóa trị cao nhất của R trong oxit là m, hóa trị trong hợp chất với hiđro là n. Ta có: m + n = 8.
Theo bài: m = 3n. Từ đây tìm được m = 6; n = 2.
=> Hóa trị của R trong hợp chất khí với H là 2.

Chọn B
R có 4 electron lớp ngoài cùng, e cuối cùng điền vào phân lớp np → R thuộc nhóm IVA
→ Hợp chất khí với hiđro và oxit cao nhất của R lần lượt là R O 2 , R H 4 .
Ta có:
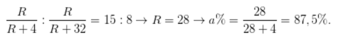
Chọn C
Hợp chất của R với hiđro là RH3 → Công thức oxit cao nhất của R là R2O5.
→ Số oxi hóa của R trong oxit cao nhất là +5.