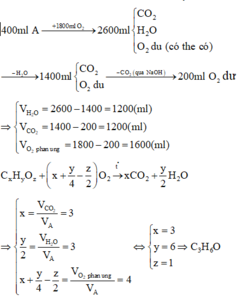Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Theo giả thiết, ta có :
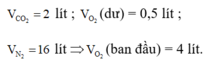
Sơ đồ phản ứng :
CxHy + O2 → CO2 +H2O + O2 dư
lít: 1 4 2 a 0,5
Áp dụng định luật bảo toàn nguyên tố đối với các nguyên tố C, H, O ta có :
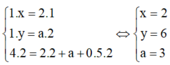
Þ Công thức của hiđrocacbon là C2H6

Đổi 10 cm3=10 ml,50cm3=50ml,70cm3=70ml,20cm3=20ml.Sản phẩm sau khi đốt cháy và ngưng tụ hơi nước có thể tích =50ml bao gồm:CO2,O2 dư,sau khi dẫn sản phẩm qua dung dịch kiềm dư thì CO2 được hấp thu vào trong dung dịch kiềm còn 20ml khí thoát ra là thể tích O2 dư=>VCO2 thu được sau khi đốt cháy=50-20=30(ml) và thể tích oxi phản ứng=70-20=50 ml.ta có pt: CxHy +(x+y/4)--->xCO2+y/2 H2O (1)
10ml--------------->x.10ml---->y/2.10ml
lại có VCO2=30=10.x=>x=3,bảo toàn nguyên tố Oxi ta có VO pu=VO(CO2)+VO(H2O)=2.VCO2+VH2O=>VH2O=50.2-30.2=40ml,lại có VH2O=y/2.10=40=>y=8
=> CTPT của X là C3H8.

Ta có: \(V_{H_2O}=1400-800=600\left(ml\right)\)
\(V_{O_2\left(dư\right)}+V_{N_2}=400\left(ml\right)\)
\(\Rightarrow V_{CO_2}=800-400=400\left(ml\right)\)
BTNT O, có: \(V_{O_2\left(pư\right)}=\dfrac{2V_{CO_2}+V_{H_2O}}{2}=700\left(ml\right)\)
\(\Rightarrow V_{O_2\left(dư\right)}=900-700=200\left(ml\right)\) \(\Rightarrow V_{N_2}=400-200=200\left(ml\right)\)
\(\Rightarrow V_{C_xH_y}=400-200=200\left(ml\right)\)
\(\Rightarrow\left\{{}\begin{matrix}x=\dfrac{V_{CO_2}}{V_{C_xH_y}}=2\\y=\dfrac{2V_{H_2O}}{V_{C_xH_y}}=6\end{matrix}\right.\)
Vậy: CTPT của X là C2H6.