Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. \(n_{O_2}=\dfrac{22.4}{22.4}=1\left(mol\right)\)
PTHH : 2KMnO4 ----to----> K2MnO4 + MnO2 + O2
2 1
\(m_{KMnO_4}=2.158=316\left(g\right)\)
b. PTHH : C + O2 ---to--->CO2
1 1 1
\(m_{CO_2}=1.44=44\left(g\right)\)

Câu 8:
\(d_{\dfrac{A}{KK}}>1\\ \Leftrightarrow M_A>M_{KK}\\ \Leftrightarrow M_A>29\\ Vậy:Chọn.A\)
(Vì 44>29>28>2)
\(Câu.7:C\\ Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\\ Câu.6:A\)

2KMnO4--->K2MnO4+MnO2+O2
a) ta có
n O2=8,4/22,4=0,375(mol)
Theo pthh
n KMnO4=2n O2=0,75(mol)
m KMnO4=0,75.158=118,5(g)
b) n KMnO4=79/158=0,5(mol)
n O2=1/2n KMnO4=0,25(mol)
V O2=0,25.22,4=5,6(l)
H=80%-->V O2=5,6.80%=4,48(l)

a)
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
b) $n_{KMnO_4} = \dfrac{79}{158} = 0,5(mol)$
Theo PTHH : $n_{O_2} = \dfrac{1}{2}n_{KMnO_4} = 0,25(mol)$
$\Rightarrow V_{O_2} = 0,25.22,4 = 5,6(lít)$
c) $n_P = \dfrac{3,1}{31} = 0,1(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy : $n_P : 4 < n_{O_2} :5$ nên $O_2$ dư
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,05(mol)$
$m_{P_2O_5} = 0,05.142 = 7,1(gam)$

C1:
nO2 = 4,48/22,4 = 0,2 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,2 . 2 = 0,4 (mol)
mKMnO4 = 0,4 . 158 = 63,2 (g)
C2:
nP = 6,2/31 = 0,2 (mol)
nO2 = 6,4/32 = 0,2 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
LTL: 0,2/4 > 0,2/5 => P dư
nP2O5 = 0,2/5 . 2 = 0,08 (mol)
mP2O5 = 0,08 . 142 = 11,36 (g)

\(n_{KMnO_4}=\dfrac{94.8}{158}=0.6\left(mol\right)\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(0.6................................................0.3\)
\(V_{O_2}=0.3\cdot22.4=6.72\left(l\right)\)
\(n_S=\dfrac{12.8}{32}=0.4\left(mol\right)\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(0.3....0.3\)
\(n_{S\left(dư\right)}=0.4-0.3=0.1\left(mol\right)\)
Vậy: lượng S vẫn còn dư sau phản ứng

\(n_{P_2O_5} = \dfrac{28,4}{142} = 0,2(mol)\)
4P + 5O2 \(\xrightarrow{t^o}\) 2P2O5
0,4...........0,5...............0,2.....................(mol)
Suy ra:
\(m_P = 0,4.31 = 12,4(gam)\\ m_{O_2} = 0,5.32 = 16(gam)\)
\(2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4\ pư} = 2n_{O_2} = 1(mol)\\ \Rightarrow m_{KMnO_4\ đã\ dùng} = \dfrac{1.158}{90\%} = 175,5(gam)\)

a) Phương trình hóa học của phản ứng:
3Fe + 2O2 → Fe3O4.
nFe3O4 = 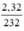 = 0,01 mol.
= 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.
\(n_{O2}=\frac{53,76}{22,4}=2,4\left(mol\right)\)
PTHH: 2KMnO4 ----> K2MnO4 + MnO2 + O2
4,8 <-------------------------------------- 2,4 (mol)
=> \(m_{KMnO4}=\frac{4,8.158.100}{90}=842,667\left(g\right)\)