Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
nCuSO4 = 0,2. 0,5 = 0,1 (mol) ; Gọi nFe phản ứng = x (mol)
PTHH: Fe + CuSO4 → FeSO4 + Cu ↓
Theo PTHH 56x 64x
Khối lượng kim loại tăng ∆ = (64x -56x)= 8x (g)
Theo đề bài ∆m tăng = ( 100,4 -100) = 0,4 (g)
=> 8x = 0,4
=> x = 0,05 (mol)
=> mFeSO4 = 0,05. 152 = 7,6 (g)

\(n_{CuSO_4}=x\left(mol\right)\)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
\(x.....x...........x........x\)
\(m_{tăng}=m_{Cu}-m_{Fe}=10.24-10=0.24\left(g\right)\)
\(\Leftrightarrow64x-56x=0.24\)
\(\Leftrightarrow x=0.03\)
\(m_{Fe\left(pư\right)}=0.03\cdot56=1.68\left(g\right)\)
\(m_{Cu}=0.03\cdot64=1.92\left(g\right)\)
\(m_{CuSO_4}=0.03\cdot160=4.8\left(g\right)\)
\(m_{dd_{CuSO_4}}=\dfrac{4.8\cdot100}{5}=96\left(g\right)\)
\(m_{\text{dung dịch sau phản ứng}}=1.68+96-1.92=95.76\left(g\right)\)
\(C\%_{FeSO_4}=\dfrac{0.03\cdot152}{95.76}\cdot100\%=4.76\%\)

Đáp án D.
Gọi x là số mol Fe phản ứng
Fe + CuSO4 → FeSO4 + Cu
1,2 = 64x – 56x → x = 0,15
Khối lượng Cu mCu = 0,15 x 64 = 9,6 (g)

\(Gọi:n_{Fepứ}=x\left(mol\right)\\ Fe+CuSO_4\rightarrow FeSO_4+Cu\\ m_{tăng}=m_{Cu}-m_{Fe}=64x-56x=1,2\\ \Rightarrow x=0,15\left(mol\right)\\ \Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)\\ \Rightarrow ChọnD\)
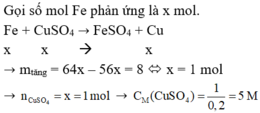

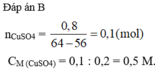

Đặt :
nFe(pư) = x mol
Fe + CuSO4 --> FeSO4 + Cu
x_____x________x______x
Khối lượng Fe tăng : 2.58 - 2.5 = 0.08 g
<=> 64x - 56x = 0.08
=> x = 0.01 mol
mddCuSO4 = 250*1.12=280 g
mCuSO4 = 42 g
nCuSO4 = 0.2625 mol
mdd sau phản ứng = 2.5+ 280 - 2.58 =279.92 g
mCuSO4 (dư ) = ( 0.2625 - 0.01 )*160 = 40.4 g
mFeSO4 = 0.01*152=1.52 g
C%FeSO4 = 1.52/279.92*100% = 0.54%
C%CuSO4 dư = 40.4/279.92*100% = 14.43%