

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Với NaOH dư, Fe, Cr không phản ứng
\(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\\\Rightarrow n_{Al}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\\ \Rightarrow \%m_{Al}=\dfrac{0,2.27}{100}=5,4\%\)
Phần không tan cho tác dụng một lượng dư dung dịch HCl
\(Fe+2HCl\rightarrow FeCl_2+H_2\\ Cr+2HCl\rightarrow CrCl_2+H_2\\ Đặt:\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Cr}=y\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}56x+52y=100-5,4=94,6\left(g\right)\\x+y=\dfrac{38,08}{22,4}=1,7\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=1,55\\y=0,15\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=86,8\\\%m_{Cr}=7,8\%\end{matrix}\right.\)

Phương trình hóa học:
2Al + 2NaOH → 2NaAlO2 + 3H2 (1)
Phần không tan là Fe và Cr
Fe + 2HCl → FeCl2 + H2 (2)
Cr + 2HCl → CrCl2 + H2 (3)
nH2 (1) = 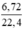 = 0,3(mol)
= 0,3(mol)
Theo pt (1) nAl = 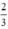 . nH2 =
. nH2 = 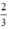 . 0,3 = 0,2 mol
. 0,3 = 0,2 mol
⇒ mAl = 27. 0,2 = 5,4 g
nH2(2),(3) = 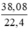 = 1,7(mol)
= 1,7(mol)
Gọi x, y lần lượt là số mol của Fe, Cr
Theo bài ra ta có hệ phương trình
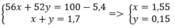
⇒ mFe = 1,55. 56 = 86,8 g
mCr = 0,15. 52 = 7,8 g
Thành phần % theo khối lượng của hỗn hợp là :
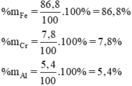

Chọn đáp án D.
Quy đổi X tương đương CH 4-x-y (COOH) x (CHO) y (a mol)
⇒ % m O = 16. ( 2 x + y ) 16 + 44 x + 28 y .100 % = 58 , 62 % (1)
Có a y = n − C H O = 1 2 n A g = 1 2 . 30 , 24 108 = 0 , 14 m o l
ax = n -COOH = n CO 2 = V 22,4 mol
Đốt cháy m g X được: n C O 2 = ( x + y + 1 ) a n H 2 O = 2 a
Áp dụng định luật bảo toàn nguyên tố O có:
2 a x + a y = 2.1 , 705 a x = 2. ( x + y + 1 ) a + 2 a ⇒ 3 , 41 x − y = 4
Từ (1) và (2) suy ra: x = 1 , 61 y = 1 , 49 ⇒ ax = 0 , 151
⇒ V = 22 , 4.0 , 151 = 3 , 3824
Gần nhất với giá trị 3,64

Chọn đáp án C
Áp dụng định luật bảo toàn electron có: n A g = 3 n N O = 3. 4 , 48 22 , 4 = 0 , 6 m o l
⇒ n H C H O = 1 4 n A g = 0 , 6 4 = 0 , 15 m o l ⇒ m C H 3 O H = 14 , 1 − 30.0 , 15 = 9 , 6 g ⇒ n C H 3 O H = 0 , 3 m o l m C H 3 C O O C H 3 = 74.0 , 3 = 22 , 2 g
⇒ Hiệu suất este hóa: H % = 16 , 65 22 , 2 .100 % = 75 %

Khi đun nóng dung dịch A
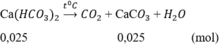
Khối lượng kết tủa tối đa thu được là m = (0,025 + 0,025).100 = 5g

CaO+H2O−−−>Ca(OH)2(1)
nCaO=0,05(mol)nCaO=0,05(mol)
Theo PTHH: nNaOH=0,05(mol)nNaOH=0,05(mol)
Dung dich A thu được là NaOHNaOH
Khi sục 1,68 lít CO2 vào dung dich A thì:
nCO2=0,075(mol)nCO2=0,075(mol)
Ta có:\(\dfrac{nCO_2}{nNaOH}=\dfrac{0,075}{0,05}=1,5\)
⇒Sản phẩm thu được gồm hai muối
CO2(0,05)+Ca(OH)2(0,05)−−−>CaCO3(0,05)+H2O(2)
CaCO3(0,025)+CO2(0,025)+H2O−−−>Ca(HCO3)2(0,025)(3)
So sánh, ta chon nNaOH để tính.
Kết tủa thu được là CaCO3 dư sau phản ứng
Theo PTHH (1) và (2) nCaCO3(dư)=0,05−0,025=0,025(mol)
⇒mCaCO3=2,5(g)⇒mCaCO3=2,5(g)
b)
Dung dich A sau phản ứng là Ca(HCO3)2
Khi nung nóng dung dich A thì:
Ca(HCO3)2(0,025)−to−>CaCO3(0,025)+CO2+H2OCa(HCO3)(4)
Theo PTHH (4): mCaCO3=2,5(g)mCaCO3=2,5(g)
⇒∑mCaCO3=2,5+2,5=5(g)

Đáp án A
Ta có sơ đồ phản ứng:
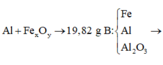
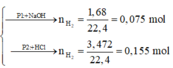
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
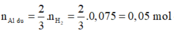
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
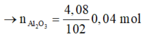
Ta có:
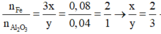
=> Oxit sắt cần tìm là Fe2O3