Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức phân tử ngậm nước là: \(RSO_4.nH_2O\)
Đề bài quá mơ hồ . Phiền em xem lại đề bài rồi

Gọi công thức muối ngậm nước có dạng: RSO 4 . nH 2 O
Theo đề bài ta có hệ phương trình:
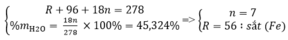
Vậy công thức của muối sắt là: FeSO 4 . 7 H 2 O

CTHH: R(NO3)2.xH2O (A)
\(\%m_{NO_3^-}=100\%-42,1875\%-9,375\%=48,4375\%\)
Xét \(\dfrac{m_R}{m_{NO_3^-}}=\dfrac{1.M_R}{2.62}=\dfrac{9,375\%}{48,4375\%}\)
=> MR = 24 (g/mol)
=> R là Mg
(A) có CTHH là Mg(NO3)2.xH2O
Có: \(\%m_{H_2O}=\dfrac{18x}{148+18x}.100\%=42,1875\%\)
=> x = 6
=> CTHH: Mg(NO3)2.6H2O

Gọi công thức của muối ngậm nước có dạng RSO4.nH2O
Theo đề bài , ta có hệ phương trình :
\(\left\{{}\begin{matrix}R+96+18n=278\\\%H_2O=\dfrac{18n}{278}\cdot100\%=45,324\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n=7\\R=56\end{matrix}\right.\)
Vậy công thức của muối sunfat trên là FeSO4.7H2O

1/ CTHH dạng TQ là ASO4 . xH2O
*Có : %S/muối tinh thể = \(\dfrac{1.M_S}{M_{ASO4.xH2O}}.100\%=11,51\%\)
=> \(\dfrac{32}{M_{ASO4.xH2O}}=0,1151\)
=> MASO4.xH2O = 278(g)
* Có : %H2O/muối tinh thể = \(\dfrac{x.M_{H2O}}{M_{ASO4.xH2O}}.100\%=45,32\%\)
=> \(\dfrac{x.18}{278}=0,4532\)
=>x= 7
*Lại có : MASO4.xH2O = 278
mà x = 7
=> MA + 96 + 7 .18=278 => MA =56(g) => A là Sắt (Fe)
Vậy CTPT của tinh thể là FeSO4 .7H2O

có mFe/Mx=0.20144
\(\Rightarrow\) Mx=278 rồi tính được n=7
ct FeSO4.7H20

Câu 1 :
Gọi CTHH muối là $M_3(PO_4)_2$
$\%P = \dfrac{31.2}{3M + 95.2}.100\% = 20\%$
$\Rightarrow M = 40(Ca)$
Vậy muối là $Ca_3(PO_4)_2$
Câu 2 :
Gọi CTHH muối là $M_3(PO_4)_2$
$\%M = \dfrac{3M}{3M + 95.2}.100\% = 38,7\%$
$\Rightarrow M = 40(Ca)$
Trong $CaCO_3$, $\%Ca = \dfrac{40}{100}.100\% = 40\%$

a) \(\%Mg=\dfrac{24}{24+2.M_X+18n}.100\%=11,82\%\)
=> MX + 9n = 89,523
Xét n = 5 => MX = 44,5 (Loại)
Xét n = 6 => MX = 35,5 => X là Cl
Xét n = 7 => MX = 26,5 (Loại)
Xét n = 8 => MX = 17,5 (loại)
Vậy CTHH của tinh thể là MgCl2.6H2O
b) \(\%Cl=\dfrac{35,5.2}{203}.100\%=34,975\%\)
c) \(n_{MgCl_2.6H_2O}=\dfrac{40,6}{203}=0,02\left(mol\right)\)
=> nH = 0,02.12 = 0,24 (mol)
=> \(n_{H_3PO_4}=\dfrac{0,24}{3}=0,08\left(mol\right)\)
=> mH3PO4 = 0,08.98 = 7,84 (g)
%R = R/(R+96+18n) *100% = 29.787%
<=> R = 0.29787( R + 96 +18n)
<=> R = 0.29787R + 28.595552 + 5.36166n
<=> 0.702313R - 5.36166n = 28.59552
BL :
n = 2 => R = 56
Vậy: CTHH : FeSO4 . 2H2O
Thành phần % của R trong dd:
..........\(\%_R=\frac{R}{R+96+18n}.100=29,787\left(\%\right)\)
<=> 0,702313R-5,36166n=28,59552
Xét n=1: 0,702313R-5,36166=28,59552=> R ko TM
n=2=>R=56(TM)=> Là Fe
=> CTHH: FeSO4.2H2O