Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b, \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(n_{HCl}=2n_{Mg}=0,4\left(mol\right)\Rightarrow V_{HCl}=\dfrac{0,4}{2}=0,2\left(l\right)=200\left(ml\right)\)

\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
a.
PTHH: Zn + 2HCl ------> ZnCl2 + H2
(mol) 1 2 1
(mol) 0,5 -> 1 -> 0,5
b. Khối lượng axit cần dùng là:
\(m_{HCl}=n_{HCl}\cdot M_{HCl}=1\cdot36,5=36,5\left(g\right)\)
c. Thể tích khí hidro thu được ở đktc là:
\(V_{H_2}=n_{H_2}\cdot22,4=0,5\cdot22,4=11,2\left(l\right)\)
d. Vì ở cùng đktc số mol tỉ lệ thể tích nên khi thể tích H2 giữ nguyên thì số mol vẫn là 0,5 mol.
PTHH: 2Al + 6HCl ------> 2AlCl3 + 3H2
(mol) 2 3
(mol) 1/3 <- 0,5
Khối lượng nhôm tham gia phản ứng là:
\(m_{Al}=n_{Al}\cdot M_{Al}=\dfrac{1}{3}\cdot27=9\left(g\right)\)
\(n_{Zn}\dfrac{32,5}{65}=0,5\left(mol\right)\)
a. PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b. Theo PT ta có: \(n_{HCl}=2.n_{Zn}=2.0,5=1\left(mol\right)\)
\(\Rightarrow m_{HCl}=1.36,5=36,5\left(g\right)\)
c. Theo PT ta có: \(n_{H_2}=n_{Zn}=0,5\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,5.22,4=11,2\left(l\right)\)
d. Thay Zn bằng Al ta có PTHH:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT câu (a) ta có: \(n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow n_{Al}=\dfrac{0,5.2}{3}=\dfrac{1}{3}\)
\(\Rightarrow m_{Al}=27.\dfrac{1}{3}=9\left(g\right)\)

a) PTHH: NaOH + Al + H2O -> NaAlO2 + 3/2 H2
b) nH2= 0,6(mol)
-> nAl=0,4(mol) => mAl=0,4.27=10,8(g)
c) nAl=0,18((mol); nNaOH=0,2(mol)
PTHH: 0,18/1 < 0,2/1
=> Al hết, NaOH dư, tính theo nAl.
-> nH2= 3/2. 0,18=0,27(mol)
=>V(H2,đktc)=0,27.22,4= 6,048(l)
\(n_{H_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(2NaOH+2Al+2H_2O\rightarrow2NaAlO_2+3H_2\)
\(...........0.4.........................0.6\)
\(m_{Al}=0.4\cdot27=10.8\left(g\right)\)
\(n_{Al}=\dfrac{4.86}{27}=0.18\left(mol\right)\)
\(n_{NaOH}=\dfrac{8}{40}=0.2\left(mol\right)\)
\(2NaOH+2Al+2H_2O\rightarrow2NaAlO_2+3H_2\)
\(2.................2\)
\(0.2...............0.18\)
\(LTL:\dfrac{0.2}{2}>\dfrac{0.18}{2}\)
\(\Rightarrow NaOHdư\)
\(n_{H_2}=0.18\cdot\dfrac{3}{2}=0.27\left(mol\right)\)
\(V_{H_2}=0.27\cdot22.4=6.048\left(l\right)\)

\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
300ml = 0,3l
\(n_{HCl}=2.0,3=0,6\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
0,3 0,6
Lập tỉ số so sánh : \(\dfrac{0,3}{2}>\dfrac{0,6}{6}\)
⇒ Al dư , HCl phản ứng hết
⇒ Tính toán dựa vào số mol của HCl
\(n_{Al\left(dư\right)}=0,3-\left(\dfrac{0,6.2}{6}\right)=0,1\left(mol\right)\)
⇒ \(m_{Al\left(dư\right)}=0,1.27=2,7\left(g\right)\)
Chúc bạn học tốt
\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right);n_{HCl}=2.0,3=0,6\left(mol\right)\)
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2
Mol: 0,2 0,6
Ta có: \(\dfrac{0,3}{2}>\dfrac{0,6}{6}\) ⇒ Al dư, HCl hết
\(m_{Aldư}=\left(0,3-0,2\right).27=2,7\left(g\right)\)

a) \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,2----->0,6
=> VH2 = 0,6.22,4 = 13,44 (l)
b) PTHH: 2Al + 6HCl ---> 2AlCl3 + 3H2
0,4<-1,2<------------------0,6
=> \(m_{ddHCl}=\dfrac{1,2.36,5}{20\%}=219\left(g\right)\)
c) PTHH: 4Al + 3O2 --to--> 2Al2O3
0,4<---0,3
=> Vkk = 0,3.22,4.5 = 33,6 (l)

a. Để tính khối lượng HCl đã dùng, ta cần biết số mol của Al đã phản ứng với HCl. Ta sử dụng phương trình phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2
Theo đó, 2 mol Al tương ứng với 6 mol HCl. Vậy số mol HCl cần để phản ứng với 2,7 g Al là:
n(HCl) = n(Al) x (6/2) = 2,7/(27x2) x 6 = 0,05 mol
Khối lượng HCl tương ứng là:
m(HCl) = n(HCl) x M(HCl) = 0,05 x 36,5 = 1,825 g
Vậy khối lượng HCl đã dùng là 1,825 g.
b. Theo phương trình phản ứng, 2 mol Al tạo ra 3 mol H2. Vậy số mol H2 tạo ra từ 2,7 g Al là:
n(H2) = n(Al) x (3/2) = 2,7/(27x2) x 3 = 0,025 mol
Theo định luật Avogadro, 1 mol khí ở ĐKTC chiếm thể tích 22,4 L. Vậy thể tích H2 thu được là:
V(H2) = n(H2) x 22,4 = 0,025 x 22,4 = 0,56 L
P.c. CuO + H2 → Cu + H2O
Khối lượng CuO cần để khử hết 0,025 mol H2 là:
n(CuO) = n(H2)/2 = 0,0125 mol
m(CuO) = n(CuO) x M(CuO) = 0,0125 x 79,5 = 0,994 g
Vậy để khử hết H2, ta cần dùng 0,994 g CuO. Nếu dùng toàn bộ lượng H2 bay ra, chất CuO sẽ bị khử hoàn toàn thành Cu và không còn chất nào còn dư.

a.\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
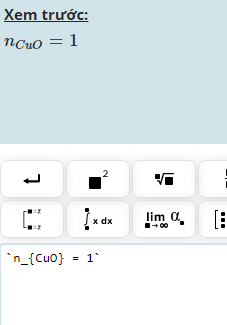
b.\(n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,6 > 0,3 ( mol )
0,3 0,3 ( mol )
\(m_{Cu}=0,3.64=19,2\left(g\right)\)
c.\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,3 0,15 ( mol )
\(V_{kk}=V_{O_2}.5=\left(0,15.22,4\right).5=16,8\left(l\right)\)

a. 2Al + 6HCl -> 2AlCl3 + 3H2
b. nAl = \(\dfrac{8.1}{27}=0,3\left(mol\right)\)=> \(n_{H_2}=\dfrac{3}{2}.0,3=0,45\left(mol\right)\)
\(V_{H_2}=0,45.22,4=10,08\left(mol\right)\)
2Al+6HCl->2AlCl3+3H2
0,5----1,5-------------------------0,75
n H2=0,075 mol
cần 10 quả bóng =>0,075.10=0,75 mol
=>mAl=0,5.27=13,5g
m HCl=1,5.36,5=54,75g
=>m dd=75g
\(n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\\ pthh:2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1125 0,15 0,075
\(m_{Al}=0,1125.27=3,0375\left(g\right)\\ m_{HCl}=\dfrac{\left(0,15.36,5\right).100}{7,3}=75\left(g\right)\)