Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử hỗn hợp ban đầu có khối lượng là 100g
CaCO3 ---to ----> CaO + CO2
Khối lượng sau =78% khối lượng hỗn hợp ban đầu
=> \(m_{sau}=100.78\%=78\left(g\right)\)
=> \(m_{giảm}=m_{CO_2}=22\left(g\right)\)
=> \(n_{CO_2}=0,5\left(mol\right)\)
Ta có : \(n_{CaCO_3}=n_{CO_2}=0,5\left(mol\right)\)
=> \(\%m_{CaCO_3}=\dfrac{0,5.100}{100}.100=50\%\)
=> %mNaCl = 50%

Gọi \(n_{CaCO_3}=x\left(mol\right);n_{MgCO_3}=y\left(mol\right)\)
\(m_{Al_2O_3}=\dfrac{100x+84y}{10}\)
Bảo toàn Ca \(\Rightarrow n_{CaO}=n_{CaCO_3}=x\left(mol\right)\)
Bảo toàn Mg \(\Rightarrow n_{MgO}=n_{MgCO_3}=y\left(mol\right)\)
\(\Rightarrow m_Y=m_{CaO}+m_{MgO}+m_{Al_2O_3}\)\(=56x+40y+\dfrac{100x+84y}{10}\)
\(\Rightarrow56x+40y+\dfrac{100x+84y}{10}=56,8\%.m_X=56,8\%.\dfrac{11}{10}.\left(100x+84y\right)\)
\(=\dfrac{781}{1250}.\left(100x+84y\right)\)\(\Leftrightarrow56x+40y=\dfrac{328}{625}\left(100x+84y\right)\)
\(\Leftrightarrow x=\dfrac{29}{25}y\)
\(\%m_{CaCO_3}=\dfrac{100x}{\dfrac{11}{10}.\left(100x+84y\right)}.100\%=\dfrac{100.\dfrac{29}{25}y}{\dfrac{11}{10}.\left(100.\dfrac{29}{25}y+84y\right)}.100\%\approx52,73\left(\%\right)\)
\(\%m_{MgCO_3}=\dfrac{84y}{\dfrac{11}{10}.\left(100x+84y\right)}.100\%=\dfrac{84y}{\dfrac{11}{10}.\left(100.\dfrac{29}{25}y+84y\right)}.100\%\approx38,18\left(\%\right)\)
\(\Rightarrow\%m_{Al_2O_3}\approx9,09\left(\%\right)\)

Ta có: mCaCO3 = 500.80% = 400 (g)
m chất rắn = 400.78% = 312 (g)
Theo ĐLBT KL, có: mCO2 = 400 - 312 = 88 (g)
\(\Rightarrow n_{CO_2}=\dfrac{88}{44}=2\left(mol\right)\)
PT: \(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
_____2_____________2 (mol)
\(\Rightarrow m_{CaCO_3\left(pư\right)}=2.100=200\left(g\right)\)
Bạn tham khảo nhé!

Pư: Mg+2HCl -> MgCl2 +H2
MgO+2HCl-> MgCl2 +H2O
MgCl2+2NaOH-> Mg(OH)2↓+2NaCl
Mg(OH)2-> MgO+H2O
nMgO=14/40=0.35 mol
-> nMg(OH)2=nMgCl2=nMgO=0.35 mol
-> nMgO=nMg=nMgCl2=0.35 mol
gọi x,y lần lượt là số mol của Mg,MgO
->mhh=24x+40y=2 (1)
nMgCl2=x+y=0.35 (2)
giải hệ (1)(2) có x=0.103125
y=0.246875
- khối lượng của bạn nhập sai vì klg hỗn hợp quá nhỏ

a. Các phương trình có thể xảy ra:
C + O2 → t ∘ CO2 (1)
CaCO3 → t ∘ CaO + CO2 (2)
MgCO3 → t ∘ MgO + CO2 (3)
CuCO3 → t ∘ CuO + CO2 (4)
C +CO2 → t ∘ 2CO (5)
C + 2CuO → t ∘ 2Cu + CO2 (6)
CO + CuO → t ∘ Cu + CO2 (7)
CaO + 2HCl →CaCl2 + H2O (8)
MgO + 2HCl →MgCl2 + H2O (9)
CuO + 2HCl →CuCl2 + H2O (10)
b. Vì sau phản ứng có CO và CO2, các phản ứng xảy ra hoàn toàn nên các chất còn lại sau khi nung là CaO, MgO và Cu không có phản ứng (10)
mCu = 3,2(g) => mCuCO3 = 6,2g
Gọi số mol CaCO3, MgCO3, C trong hỗn hợp lần lượt là a, b, c.(*)
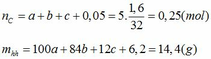
Giải ( *), (**), (***) ta được a=0,025; b=0,05; c=0,125.
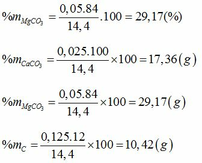

PTHH:
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
x....................x
\(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
y...................................0,5y
Gọi số mol Mg(OH)2, Fe(OH)2 lần lượt là x, y (mol)
Theo đề ra, ta có:
\(\begin{cases}58x+90y=1,32a\\40x+80y=a\end{cases}\)
\(\Rightarrow\begin{cases}x=0,015a\\y=0,005a\end{cases}\)
=> mMgO = 0,015a x 40 = 0,6a (gam)
=> %mMgO = \(\frac{0,6a}{a}.100\%=60\%\)
=> %mFe2O3 = 100% - 60% = 40%
PTHH: Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Gọi số mol của Mg(OH)2 là x , số mol của Fe(OH)2 là y => Số mol của MgO là a , số mol của FeO là b
Ta có hệ phương trình sau:
- 58x + 90y = 1,32a (1)
- 40x + 72y = a (2)
Nhân phương trình (2) với 1,32 ta có :
52,8x + 95,04y = 1,32a (3)
Vì phương trình (3) và phương trình (1) đều bằng 1,32a
=> 58x + 90y = 52,8x + 95,04y
=> x = 0,97y
%MgO trong hỗn hợp oxit là:
40x/40x+72y.100%=40.0,97y/40.0,97y+72y.100%=35,02%.40x/40x+72y.100%=40.0,97y/40.0,97y+72y.100%=35,02%
%FeO trong hỗn hợp oxit là:
100% - 35,02% = 64,98%

Gọi số mol FeCO3, ZnCO3 là a, b (mol)
PTHH: FeCO3 --to--> FeO + CO2
a----------->a
ZnCO3 --to--> ZnO + CO2
b--------->b
mbđ = 116a + 125b (g)
msau pư = 72a + 81b (g)
=> \(\dfrac{72a+81b}{116a+125b}=\dfrac{6,21}{9,73}\)
=> 19,8a = 11,88b
=> a = 0,6b
\(\%m_{FeCO_3}=\dfrac{116a}{116a+125b}.100\%=\dfrac{116.0,6b}{116.0,6b+125b}.100\%=35,766\%\)
=> \(\%m_{ZnCO_3}=100\%-35,766\%=64,234\%\)
Với các bài tập chỉ có tỉ lệ và phần trăm, có thể đặt một lượng chất bất kì. Đối với bài này, đặt khối lượng chất rắn thu được là 6,21 gam, khối lượng muối ban đầu là 9,73 gam
FeCO3 → FeO + CO2 ZnCO3 → ZnO + CO2
a a b b mol
mFeCO3 + mZnCO3 = 116a + 125b = 9,73 gam
mFeO + mZnO = 72 + 81b = 6,21 gam
a = 0,03 mol; b = 0,05 mol

mFe2O3 = 9.8%*100=9.8g mAl2O3= 10.2% *100=10.2g
=>mCaCO3 = 80g Theo đề, lượng chất rắn thu được sau khi nung chỉ bằng 67% lượng hỗn hợp ban đầu.Như vậy độ giảm khối lượng là do CO2 sinh ra bay đi.
mCO2=100-67=33g => nCO2= 33/44=0.75 mol
PTHH: CaCO3 ---t0---> CaO + CO2
0.75................0.75......0.75
mCaCO3=0.75*100=75g
Như vậy còn 5g CaCO3 còn dư. Do đó chất rắn tạo ra gồm:
CaCO3 dư, Al2O3, Fe2O3 và CaO.
%Al2O3= \(\dfrac{10.2}{67}\cdot100=15.22\%\)
%Fe2O3=\(\dfrac{9.8}{67}\cdot100=14.62\%\)
mCaO = 0.75*56=42g
=> %mCaO = 42%
mFe2O3 = 9.8%*100=9.8g mAl2O3= 10.2% *100=10.2g
=>mCaCO3 = 80g Theo đề, lượng chất rắn thu được sau khi nung chỉ bằng 67% lượng hỗn hợp ban đầu.Như vậy độ giảm khối lượng là do CO2 sinh ra bay đi.
mCO2=100-67=33g => nCO2= 33/44=0.75 mol
PTHH: CaCO3 ---t0---> CaO + CO2
0.75................0.75......0.75
mCaCO3=0.75*100=75g
Như vậy còn 5g CaCO3 còn dư. Do đó chất rắn tạo ra gồm:
CaCO3 dư, Al2O3, Fe2O3 và CaO.
%Al2O3= 10.267⋅100=15.22%10.267⋅100=15.22%
%Fe2O3=9.867⋅100=14.62%9.867⋅100=14.62%
%CaCO3dư = \(\dfrac{5}{67}\cdot100=7.4\%\)
=>%CaO=62.69%
Coi mhh ban đầu = 100g
⇒%mAl2O3 = 1/8 * 100% = 12,5%
PTHH
CaCO3 ➜ CaO + CO2
MgCO3 ➜ MgO + CO2
Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y, ta có:
100x + 84y = (100 - 1/8 * 100) = 87,5 (1)
lại có:
(100 - mCO2) / 100 = [100 - 44(x+y)] / 100 = 6/10
⇒x + y = 0.91 (2)
Giải (1) và (2) ta được: x = 0,69125; y = 0,21875
%mCaCO3 = [(0,69125 * 100) / 100] * 100% = 69,125%
%mMgCO3 = 100% - 12,5% - 69,125% = 18,375%