Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi Ct tổng quát của sắt clorua cần tìm là FexOy (x,y: nguyên, dương)
Theo đề bài, ta có:
\(\frac{\%m_{Fe}}{x.M_{Fe}}=\frac{\%m_{Cl}}{y.M_{Cl}}\\ < =>\frac{44}{56x}=\frac{56}{35,5y}\\ < =>\frac{x}{y}=\frac{44.35,5}{56.56}\approx\frac{1}{2}\)
=> x=1; y= 2
Vây với x=1; y=2 thì CTHH của sắt clorua cần tìm là FeCl2 (sắt (II) clorua).
Gọi công thức tổng quát của hợp chất đó là \(Fe^{a?}Cl^I_2\)
Theo quý tắc hóa trị, ta có:
a.I= 1.2
<=>\(a=\frac{I.2}{1}=II\)
Vậy: Trong hợp chất sắt clorua thì Fe có hóa trị II.

gọi CTHH cần tìm là FexCly
Ta có tỉ lệ x: y= 34,46%/56: 65,54%/35,5
x:y= 0,615: 1,846
x:y=1:3
x=1, y=3 CTHH cần tìm là FeCl3
Vậy hóa trị của Fe trong CTHH trên là 3
1 loại sắt clorua chứa 34,46% Fe và 65,54% cl. xác định hóa trị Fe trong hợp chất trên
2345

a)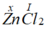
Gọi x là hóa trị của Zn.
Theo quy tắc hóa trị ta có 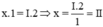 . Vậy hóa trị của Zn là II
. Vậy hóa trị của Zn là II
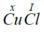
Gọi x là hóa trị của Cu.
Theo quy tắc hóa trị ta có 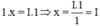 . Vậy hóa trị của Cu là I
. Vậy hóa trị của Cu là I
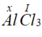
Gọi x là hóa trị của Al.
Theo quy tắc hóa trị ta có 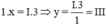 . Vậy hóa trị của Al là III
. Vậy hóa trị của Al là III
b)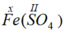
Gọi hóa trị của Fe là x, nhóm SO4 có hóa trị II
Theo quy tắc hóa trị ta có : 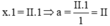
Vậy hóa trị của Fe trong hợp chất FeSO4 là II

Gọi CTHH của HC là: FeClx (x là hoa trị của Fe)
Ta có:
\(\dfrac{35,5.x}{56+35,5x}.100\%=65,54\%\)
=>x=3
Vậy hóa trị của Fe là III

Gọi CTHH của hợp chất là FexCly.
Ta có: 56x + 35,5y = 127
Với x = 1 ⇒ y = 2 → FeCl2.
Với x = 2 ⇒ y = 0,42 (loại)
Với x = 3 ⇒ y = -1,15 (loại)
Vậy: CTHH cần tìm là FeCl2

2) \(\%m_{\dfrac{O}{FeO}}=\dfrac{16}{72}.100\approx22,222\%\\ \%m_{\dfrac{O}{Fe2O3}}=\dfrac{3.16}{160}.100=30\%\\ \%m_{\dfrac{O}{Fe3O4}}=\dfrac{64}{232}.100\approx27,586\%\)
Bài 1:
%mO=48%
M(phân tử)= (2.56)/28%=400(g/mol)
Số nguyên tử S: (24% . 400)/32= 3(nguyên tử)
Số nguyên tử O: (48% . 400)/16= 12(nguyên tử)
=> CTHH: Fe2(SO4)3

1. Hóa trị Fe lần lượt là: II, III, III, II, III
2. Hóa trị các nguyên tố lần lượt là: II, II, I, III
1. gọi hóa trị của các nguyên tố cần tìm là \(x\)
\(\rightarrow\) \(Fe_1^xO^{II}_1\rightarrow x.1=II.1\rightarrow x=II\)
vậy \(Fe\) hóa trị \(II\)
\(\rightarrow Fe_2^xO^{II}_3\rightarrow x.2=II.3\rightarrow x=III\)
vậy \(Fe\) hóa trị \(III\)
tính tương tự với \(Fe\left(OH\right)_3,FeSO_4\) và \(Fe_3\left(PO_4\right)_2\)
câu 2 làm tương tự
nếu bạn đã nắm chắc về hóa trị rồi thì câu 3 chỉ cần nhìn chéo là tính được

a. Sắt (II) Oxit: \(FeO\)
Sắt (III) Oxit: \(Fe_2O_3\)
Nito Oxit: \(N_2O\)
Sắt sunfua: \(FeS\)
b. Oxit lưu huỳnh chứa 50%S
Gọi CTHH tạm thời là: \(S_xO_y\)
Ta có: \(\dfrac{32x}{16y}=\dfrac{50\%}{50\%}\Leftrightarrow\left\{{}\begin{matrix}x=1\\y=2\end{matrix}\right.\)
\(\Rightarrow CTHH:SO_2\)
Oxit lưu huỳnh chứa 40%S
Gọi CTHH tạm thời là: \(S_xO_y\)
Ta có: \(\dfrac{32x}{16y}=\dfrac{40\%}{60\%}\Leftrightarrow\left\{{}\begin{matrix}x=1\\y=3\end{matrix}\right.\)
\(\Rightarrow CTHH:SO_3\)
Tính hóa trị S trong mỗi hợp chất sắt sunfua chứa 63,6%Fe và 36,4%S. Tính hóa trị Fe trong hợp chất.
Gọi CTHH tạm thời là: \(Fe_xS_y\)
Ta có: \(\dfrac{56x}{32y}=\dfrac{63,6\%}{36,4\%}\Leftrightarrow\left\{{}\begin{matrix}x=1\\y=1\end{matrix}\right.\)
Vậy hóa trị của Fe trong hợp chất là hai vì lưu huỳnh và Fe có nhiều hóa trị nhưng chỉ cùng có chung một hóa trị là hai.
%Cl = 100 - 44 = 56 (%)
Gọi CT sắt clorua là: FeClx (x:hóa trị của Fe)
Theo đề bài ta có:
56/35.5x = 44/56 ===> x = 2
Vậy hóa trị của sắt trong hợp chất là 2
CT: FeCl2