Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử có 100 gam quặng sắt, khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam
Số mol Fe2O3 là nFe2O3 = 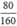 = 0,5(mol)
= 0,5(mol)
nFe = 2 x nFe2O3 = 0,5.2 = 1(mol)
→ mFe = 1.56 = 56(g)
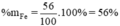
Tương tự tính cho Si , %Si = 4,7%
Đáp án là A.

Đáp án C
Quặng hematit đỏ chứa Fe2O3 khan → %Fe = 2 × 56 : 160 = 70%.
• Quặng hemantit nâu chứa Fe2O3.nH2O → %Fe < 70%.
• Quặng manhetit chứa Fe3O4 → %Fe = 3 × 56 : 232 ≈ 72,41%.
• Quặng xiđerit chứa FeCO3 → %Fe = 56 : 116 ≈ 48,28%
→ Quặng chứa hàm lượng sắt lớn nhất là manhetit

Đáp án C
a) đúng vì Al có lớp màng oxit bảo vệ
b) đúng
c) sai, nhôm chỉ tồn tại ở dạng hợp chất
d) đúng thép ( chứa từ 0,01- 2% C) còn gang chứa từ (2- 5% C) => thép có hàm lượng Fe cao hơn gang.
e) Sai vì Fe là nguyên tố phổ biến thứ tư trong vỏ trái đất
f) đúng
=> có 4 phát biểu đúng



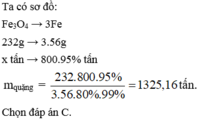
Giả sử có 100 gam quặng sắt thì khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam
=> \(n_{Fe}=2n_{Fe_2O_3}=2.\dfrac{80}{160}=1\left(mol\right)\\ n_{Si}=n_{SiO_2}=\dfrac{10}{60}=\dfrac{1}{6}\left(mol\right)\)
Ta có :
\(\%Fe=\dfrac{m_{Fe}}{m_{quặng}}.100=\dfrac{1.56}{100}=56\%\\ \%Si=\dfrac{m_{Si}}{m_{quặng}}=\dfrac{\dfrac{1}{6}.28}{100}=4,7\%\)
=> Chọn A
A.