Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D.
Tổng mol Ca2+, Mg2+ trong mẫu nước cứng là 0,005 mol Þ HCO3-: 0,01 mol.
Để kết tủa hoàn toàn thành CaCO3 thì: 0,01 = 0,002 + 0,05x Þ x = 0,16 = 160 ml

Do dd Y vẫn còn màu xanh => Cu2+ chưa điện phân hết. Gọi a là số mol đã Cu2+ điện phân.
Cu2+ + 2e ---> Cu
a............2a.........a
2H2O ---> 4H+ + O2 + 4e
.................2a.....0.5a....2a
Ta có: mgiảm = mCu + mO2
=> 64a + 0.5a*32 = 8 => a = 0.1
nCu2+ chưa đp = 0.2x - 0.1
Fe + 2H+ --->....
0.1....0.2
Fe + Cu2+ ----> Cu
0.2x-0.1.............0.2x-0.1
mFe bđầu - mFe pứ acid + mtăng do Fe + Cu2+ = mkl
=> 16.8 - 0.1*56 + 8*(0.2x - 0.1) = 12.4
=> x = 1.25
=> Đáp án D

Đáp án A
Khi cho NaOH, hay Ca(OH)2 dư tác dụng 1/2 dd X, đều xảy ra phản ứng:
HCO3- + OH- → CO32- + H2O. (1)
Ca2+ + CO32- → CaCO3. (2)
Khi tác dụng Ca(OH)2 dư thì do Ca2+ và OH- dư nên n(↓ phần 2) = n(HCO3-) = 4 , 5 100 = 0,045 mol.
Khi tác dụng NaOH dư, do OH- dư nên HCO3- phản ứng hết. với n(HCO3-) = 0,045. Trong khi n(↓ phần 1) = 2 100 = 0,02 < 0,045
⇒ kết tủa tính theo Ca2+ với n(Ca2+) = n (↓ phần 1) = 0,02 mol.
Bảo toàn điện tích (trong 1/2 dd) → n(Na+) + 2n(Ca2+)= n(HCO3-) + n(Cl-)
=> n(Na+) = 0,045 + 0,035- 0,02.2= 0,04 mol
Khi đun sôi thu được muối chứa Na+( tính trong 1/2 dd):
2HCO3- → CO32- + CO2+ H2O
0,04 mol Na+; 0,02 mol Ca2+; 0,035 mol Cl-; 0 . 045 2 CO32-.
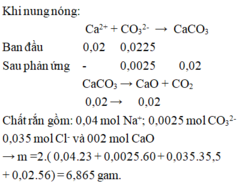
Khi nung nóng:
Ca2+ + CO32- → CaCO3
Ban đầu 0,02 0,0225
Sau phản ứng - 0,0025 0,02
CaCO3 → CaO + CO2
0,02 → 0,02
Chất rắn gồm: 0,04 mol Na+; 0,0025 mol CO32-; 0,035 mol Cl- và 002 mol CaO
→ m =2(0,04.23 + 0,0025.60 + 0,035.35,5 + 0,02.56) = 6,865 gam.

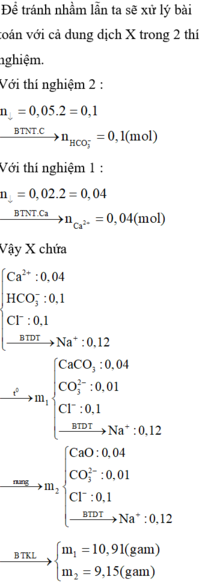

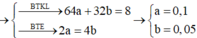



Đáp án B
Bảo toàn điện tích : 2nCa + 2nMg = nHCO3 + nCl = (0,002 + 0,008).0,2 = 0,002 mol
=> nCa + nMg = 0,001 mol
Sau đun nóng : 2HCO3- -> CO32- + CO2 + H2O
Để làm mềm nước cứng cần kết tủa Ca2+ và Mg2+ bằng CO32-
=> nCO3 = nCa + nMg = nNa2CO3.10H2O + nCO32-(đun nóng)
=> nNa2CO3.10H2O = 0,0008 mol
=> mmuối = 0,2288g
=>B