Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo định luật bảo toàn điện tích có:

Nên tổng khối lượng kết tủa thu được lớn nhất gồm 0,02 mol Mg(OH)2, 0,01 mol Al(OH)3 và 0,02 mol BaSO4
Đáp án B

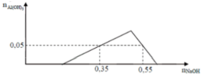
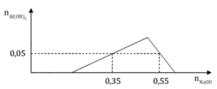
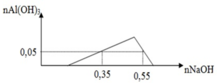
Tại nOH- = 0,35 thì Al(OH)3 chưa đạt cực đại ⇒ Al3+ còn dư
H+ + OH- → H2O
Al3+ + 3OH- → Al(OH)3
⇒ nOH- = nH+ + 3n↓ ⇒ 0,35 = x + 3.0,05 ⇒x = 0,2
Tại nOH- = 0,55 thì Al(OH)3 đạt cực đại và bị tan bớt 1 phần
H+ + OH- → H2O
0,2 → 0,2
Al3+ + 3OH- → Al(OH)3
y → 3y → y
Al(OH)3 + OH- → AlO2- + 2H2O
(y – 0,05) → (y – 0,05
⇒ nOH- = 0,2 + 3y + y – 0,05 = 0,55 ⇒ y = 0,1
Bảo toàn điện tích ⇒ 0,2 + 0,1.3 = 2z + 0,1 ⇒z = 0,2
Khi cho 0,27 mol Ba(OH)2 vào dung dịch X thì
Ba2+ + SO42- → BaSO4↓
0,2 → 0,2
H+ + OH- → H2O
0,2 → 0,2
Al3+ + 3OH- → Al(OH)3
0,1 → 0,3 → 0,1
Al(OH)3 + OH- → AlO2- + 2H2O
0,04 ← 0,04
⇒ mY = mBaSO4 + mAl(OH)3 = 0,2.233 + 0,06.78 = 51,28g ⇒ Chọn D.

Phân tích thí nghiệm của dung dịch X với NaOH
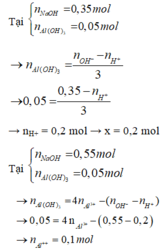

Thí nghiệm 2
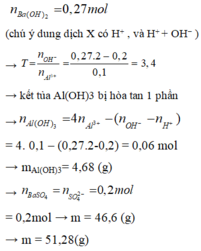
Đáp án C

Để thu được lượng kết tủa lớn nhất thì ∑nCa2+ + nBa2+ = nCO32-
Ca(OH)2 → Ca2+ + 2OH-
aV → aV → 2aV
OH- + HCO3- → CO32- + H2O
2aV → 2aV → 2aV
∑nCa2+ + nBa2+ = nCO32- ⇒ (x + aV) + y = 2aV x + y = aV ⇒ V = x + y a ⇒ Chọn D.

Đáp án D
Ta có: x = 0,35 – 0,05.3 = 0,2
Tại điểm kết tủa cực đại là
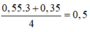
=> z = 0,2.
Khi thêm 0,27 Ba(OH)2 thì thu được kết tủa Z chứa
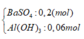
=> m = 51,28 gam

Đáp án A.
nAl(OH)3= 7 , 8 78 = 0 , 1
2NaOH + H2SO4 à Na2SO4 + 2H2O (1)
0,2 ß 0,1
Để NaOH phản ứng nhiều nhất thu được 0,1 mol kết tủa Al(OH)3 thì Al2(SO4)3 phải phản ứng hết tạo kết tủa tối đa, sau đó kết tủa tan một phần sao cho lượng kết tủa cuối cùng thu được bằng 0,1 mol.
6NaOH + Al2(SO4)3 à 3Na2SO4 + 2Al(OH)3 (2)
0,6 ß 0,1 à 0,2
NaOH + Al(OH)3 à NaAlO2 + 2H2O (3)
0,1 ß 0,1
Từ (1), (2) và (3) ta có:
nNaOH pư = 0,6 + 0,1 + 0,2 = 0,9 mol
è → Vdd NaOH = 0,9 : 2 = 0,45 M

Đáp án D
V có giá trị lớn nhất vậy có các phương trình

Vậy nNaOH = 0,9 ⇒ V = 0,45



Đáp án A