Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1 :
\(CT:P_xO_y\)
\(\%P=\dfrac{31x}{142}\cdot100\%=43.66\%\)
\(\Rightarrow x=2\)
\(M_B=31\cdot2+16\cdot y=142\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow y=5\)
\(CTPT:P_2O_5\)

Công thức hoá học các hợp chất với oxi và hiđro là CO 2 và CH 4

Gọi công thức oxit sắt cần tìm là F e X O Y
Theo bài ta có: : = 7 : 3
Ta coi m F e = 7 gam; m O = 3 gam.
Khi đó:
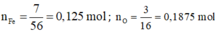
⇒ m C a O H 2 = 2.(40+17.2) = 148kg
⇒ n F e : n O = x : y = 0,125 : 0,1875 = 2 : 3
Vậy oxit sắt cần tìm là F e 2 O 3
⇒ Chọn A.

Lưu huỳnh là nguyên tố phi kim hoạt động hoá học mạnh hơn photpho nhưng yếu hơn clo.

Nguyên tố R tạo thành hợp chất khí với hiđro có công thức là RH 4 sẽ tạo thành hợp chất oxit cao nhất là RO 2 có phần trăm khối lượng của nguyên tô R :
100% - 72,73% = 27,27%
72,73% phân tử khối của RO 2 ứng với 16 x 2 = 32 (đvC).
27,27% phân tử khối của RO 2 ứng với nguyên tử khối của nguyên tố R là :
32x27,27/72,73 = 12 (đvC) => R là cacbon (C)

(a) Phản ứng nổ của TNT: 2C7H5N3O6 → 3N2 + 5H2O + 7CO + 7C
(b) 100 gam thuốc nổ Hexanit có chứa 60 gam TNT và 40 gam HND.
Số mol của từng chất là:
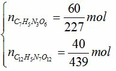
Áp dụng định luật bảo toàn nguyên tố ta có:
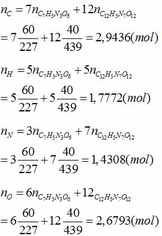
- Phần trăm khối lượng mỗi nguyên tố trong Hexanit:
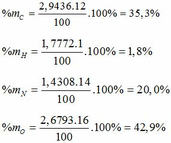
- Sản phẩm nổ của Hexanit là N2, H2O, CO, C
- Áp dụng định luật bảo toàn nguyên tố ta tính được số mol của các chất trong hỗn hợp sau khi nổ:
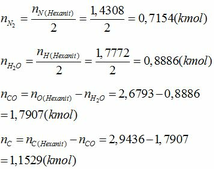
Phần trăm số mol của các chất trong hỗn hợp sau khi nổ:
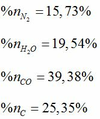

a) X là Cl2
Z là hợp chất 2 nguyên tố, Z là muối của Kali trong đó chiếm 52,35% về khối lượng => Z là KCl
Y là hợp chất 2 nguyên tố, trong đó có chứa Clo, dd Y làm quỳ tím chuyển sang màu đỏ => Y là axit => Y là HCl
Đất đèn +HCl → F => F là C2H2
Ta có sơ đồ sau:
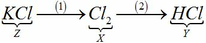

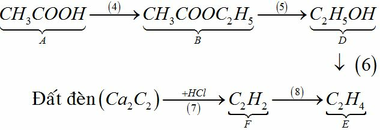
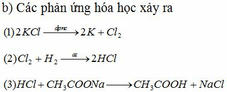
4 C H 3 C O O N a + C 2 H 5 O H ↔ H 2 S O 4 , t ∘ C H 3 C O O C 2 H 5 + H 2 O 5 C H 3 C O O C 2 H 5 + N a O H → C H 3 C O O N a + C 2 H 5 O H
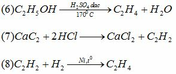

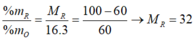

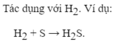
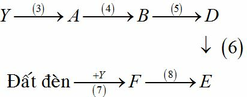
Chất này là KAl(OH)4. Còn cách giải thì mình chưa biết 😂😂😂