
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nồngđộ mol ( mol/l, M):- Là số mol chất tan có trong mộtđơ n vị thể tích dung dịch. Nồngđộ molthayđổi theo nhiệtđộ.số mol chất tan (n)CM = (đơ n vị mol/l, mmol/l )thể tích dung dịch (v)2. Nồngđộ molan (m):- Là số mol chất tan có trong 1 kg dung môi, không thayđổi theo nhiệtđộ.số mol chất tan (g)Cm =số kg dung môi (kg)

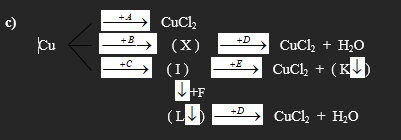
Câu 92:
\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ ZnO+2HCl\to ZnCl_2+H_2O\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ \Rightarrow n_{Zn}=0,1(mol)\\ \Rightarrow m_{Zn}=0,1.65=6,5(g)\\ \Rightarrow \%_{Zn}=\dfrac{6,5}{14,6}.100\%\approx44,52\%\\ \Rightarrow \%_{ZnO}=100\%-44,52\%=55,48\%\\ b,m_{ZnO}=14,6-6,5=8,1(g)\\ \Rightarrow n_{ZnO}=\dfrac{8,1}{81}=0,1(mol)\\ \Rightarrow \Sigma n_{HCl}=2n_{Zn}+2n_{ZnO}=0,4(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,4}{0,5}=0,8(mol)\)
Câu 93:
\(n_{H_2}=\dfrac{16,8}{22,4}=0,75(mol)\\ PTHH:Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow n_{Fe}=n_{H_2}=0,75(mol)\\ \Rightarrow m_{Fe}=0,75.56=42(g)\\ b,n_{H_2SO_4}=n_{H_2}=0,75(mol)\\ \Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,75}{0,25}=3M\\ c,n_{FeSO_4}=0,75(mol)\\ \Rightarrow m_{CT_{FeSO_4}}=0,75.152=114(g)\\ V_{dd_{FeSO_4}}=V_{dd_{H_2SO_4}}=250(ml)\\ \Rightarrow m_{dd_{FeSO_4}}=250.1,1=275(g)\\ \Rightarrow C\%_{FeSO_4}=\dfrac{114}{275}.100\%\approx41,45\%\)
\(d,m_{FeSO_4.5H_2O}=242.0,75=181,5(g)\)

Trích mẫu thử
Cho quỳ tím vào từng chất:
+ Quỳ tím hoá đỏ => HCl
+ Không đổi màu => NaCl, Na2SO4
Cho BaNO3 vào 2 dung dịch còn lại
+ Kết tủa trắng => Na2SO4
+ Không tạo kết tủa => NaCl
có pthh nha
Trích mẫu thử
Cho quỳ tím vào từng chất:
+ Quỳ tím hoá đỏ => HCl
+ Không đổi màu => NaCl, Na2SO4
Cho Ba(NO3)2 vào 2 dung dịch còn lại
+ Kết tủa trắng => Na2SO4
Ba(NO3)2 + Na2SO4 \(\rightarrow BaSO_4+2NaNO_3\)
+ Không tạo kết tủa => NaCl
Ba(NO3)2 + 2NaCl \(\rightarrow\) BaCl2 + 2NaNO3

Vì tính oxi hóa : $AgNO_3 > Cu(NO_3)_2$
nên $AgNO_3$ hết, $Cu(NO_3)_2$ có thể dư
$n_{Ag} = n_{AgNO_3} = 0,1.2 = 0,2(mol)$
$\Rightarrow n_{Cu} = \dfrac{34,45 - 0,2.108}{64} = 0,2 > n_{Cu(NO_3)_2$ =0,15$
$\to$ Loại
Vậy $AgNO_3,Cu(NO_3)_2$ hết, Zn dư
$\Rightarrow m_{Zn\ dư} = 34,45 - (0,2.108 + 0,15.64) = 3,25(gam)$
Bảo toàn e $n_{Zn\ pư} = \dfrac{0,2}{2} + 0,15 = 0,25(mol)$
$\Rightarrow m = 0,25.65 + 3,25 = 19,5(gam)$

PTHH: \(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
a) Gọi số mol Nhôm p/ứ là 2x (mol) \(\Rightarrow n_{Cu}=3x\left(mol\right)\)
Ta có: \(10-27\cdot2x+64\cdot3x=11,38\) \(\Rightarrow x=0,01\left(mol\right)\)
\(\Rightarrow m_{Cu}=3\cdot0,01\cdot64=1,92\left(g\right)\)
b) Theo PTHH: \(\left\{{}\begin{matrix}n_{CuSO_4\left(dư\right)}=0,2-0,03=0,17\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=0,01\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{CuSO_4\left(dư\right)}}=\dfrac{0,17}{0,5}=0,34\left(M\right)\\C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,01}{0,5}=0,02\left(M\right)\end{matrix}\right.\)




a)
$n_{H_2} = \dfrac{8,96}{22,4} = 0,4(mol)$
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,4 0,8 0,4 (mol)
$\%m_{Mg} = \dfrac{0,4.24}{10}.100\% = 96\%$
$\%m_{Cu} = 100\% - 96\% = 4\%$
b)
$C_{M_{HCl}} = \dfrac{0,8}{0,5} = 1,6M$
c)
$n_{Cu} = \dfrac{10 - 0,4.24}{64} = \dfrac{1}{160}(mol)$
$Mg + 2H_2SO_4 \to MgSO_4 + SO_2 + 2H_2O$
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + 2H_2O$
$n_{SO_2} = n_{Mg} + n_{Cu} = 0,40625(mol)$
$V_{SO_2} = 0,40625.22,4 = 9,1(lít)$

 Mọi người giúp m với
Mọi người giúp m với






Một hợp chất khí, phân tử có 85,7% C về khối lượng, còn lại là H. Phân tử khối của hợp chất là 28. Tìm số nguyên tử của mỗi nguyên tố trong 1 phân tử hợp chất.