Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{KMnO_4}=0,1\left(mol\right)\)
\(PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(\Rightarrow n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\)
Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
Bảo toàn e:\(\Rightarrow2a+3b=0,5\)
Mặt khác: \(64a+56b=13,6-0,05.32=12\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1.56}{12}.100\%=46,67\left(\%\right)\)
Tại sao lại có 2a+3b=0,5 ạ ?
Qúa trình nhường e của Fe diễn ra ntn ạ ?

a)
$FeO + 2HCl \to FeCl_2 + H_2O$
$Fe + 2HCl \to FeCl_2 + H_2$
$2FeO + 4H_2SO_4 \to Fe_2(SO_4)_3 + SO_2 + 4H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b)
n Fe = n H2 = 4,48/22,4 = 0,2(mol)
n SO2 = 7,84/22,4 = 0,35(mol)
Bảo toàn e :
n FeO + 3n Fe = 2n SO2
=> n FeO = 0,35.2 - 0,2.3 = 0,1(mol)
=> m = 0,1.72 + 0,2.56 = 18,4 gam

nH2=4,48/22,4=0,2 mol
Fe +2HCl -->FeCl2+H2
0,2 0,2 mol
=>mFe=0,2*56=11,2 g
nSO2=10,08/22,4=0,45 mol
gọi số mol của Cu là a mol
bảo toàn e ta có
Cu\(^0\)-->Cu\(^{+2}\)+2e
a 2a S\(^{+6}\) + 2e -->S\(^{+4}\)
Fe\(^0\)--> Fe\(^{+3}\)+3e 0,45 0,9
0,2 0,6
=>a=0,15=>mCu=0,15*64=9,6 g
=>mhh=9,6+11,2=20,8g
=>%Cu=9,6*100/20,8=46,15%
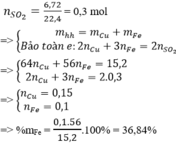
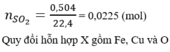
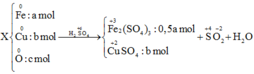
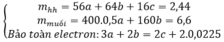
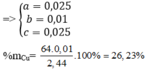
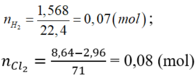
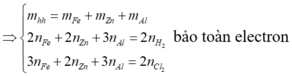
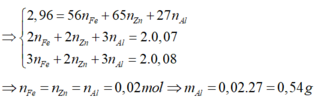
yêu cầu đề bài là gì hả a
Tính SO2 bro à =))