Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_C=n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right);n_H=2.n_{H_2O}=2.0,2=0,4\left(mol\right)\\ m_C+m_H=0,15.12+0,4.1=2,2\left(g\right)=m_X\\ Đặt.CTPT.X:C_aH_b\left(a,b:nguyên,dương\right)\\ a:b=0,15:0,4=3:8\\ Vậy.CTPT.X:C_3H_8\)

a.

b.
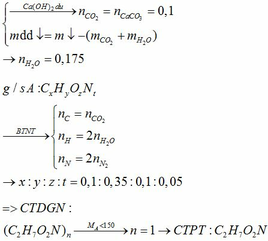
Vì A pứ với NaOH nên CTCT của A là: CH3COONH4 hoặc HCOONH3CH3
Y pứ ở 15000C nên Y là: CH4
=> X: CH3COONa → A:CH3COONH4
Z: CH≡CH → T: CH3CHO
Vậy A là: CH3COONH4 (amoniaxetat)

a) Áp dụng ĐLBTNT:
+) Bảo toàn C: \(n_C=n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
+) Bảo toàn H: \(n_H=2n_{H_2O}=2.\dfrac{2,7}{18}=0,3\left(mol\right)\)
+) Bảo toàn: \(n_O=\dfrac{3,7-0,3-0,15.12}{16}=0,1\left(mol\right)\)
CTPT: CxHyOz
=> x : y : z = 0,15 : 0,3 : 0,1 = 3 : 6 : 2
=> CTPT: C3H6O2
b) A là: CH3-CH2-COOH
B là: CH3COOCH3

Đốt chất hữu cơ A (C, H, O) bằng O 2 dư → C O 2 , H 2 O (hơi) và O 2 . Qua dung dịch Ca(OH)2 hơi H2O ngưng tụ còn C O 2 tạo muối cacbonat, khí O 2 không tan trong nước và không tác dụng với nước nên thoát ra khỏi bình.
Vậy khối lượng bình tăng chính là khối lượng của C O 2 và H 2 O . m C O 2 + m H 2 O = m

Ta có: \(n_{CO_2}=\dfrac{13,2}{44}=0,3\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
⇒ mC + mH = 0,3.12 + 0,6.1 = 4,2 (g) < mA
⇒ A có các nguyên tố C, H và O.
⇒ mO = 9 - 4,2 = 4,8 (g)
\(\Rightarrow n_O=\dfrac{4,8}{16}=0,3\left(mol\right)\)
Giả sử CTPT của A là CxHyOz. (x, y, z nguyên dương)
⇒ x : y : z = 0,3 : 0,6 : 0,3 = 1: 2 : 1
⇒ CTĐGN của A là (CH2O)n (n nguyên dương)
Mà: MA = 180 (g/mol)
\(\Rightarrow n=\dfrac{180}{12+2+16}=6\left(tm\right)\)
Vậy: A là C6H12O6.
Bạn tham khảo nhé!

nC = nCO2 = 0,15 (mol); nH = 2nH2O = 2.0,2 = 0,4 (mol)
mC + mH = 0,15.12 + 0.4.2 = 2,2 gam => không có O
nC : nH = 0,15 : 0,4 = 3 : 8
Mà M = 22.2 = 44 => CTPT là C3H8
Vì C3H8 chỉ có một công thức cấu tạo nên kết luận của phòng thí nghiệm là đúng.

Ta có M A = M B = 14 x 2 = 28 (gam).
A là hợp chất khi đốt chỉ tạo ra CO 2 . Vậy A phải chứa cacbon và oxi. Mặt khác, M A = 28 gam → công thức của A là CO.
B khi cháy sinh ra CO 2 và H 2 O, vậy trong B có cacbon và hiđro.
Ta có m C = 4,4/44 x 12 = 1,2g
m H = 1,8/18 x 2 = 0,2g
Vậy m B = m C + m H = 1,2 + 0,2 = 1,4 (gam).
=> Trong B chỉ có 2 nguyên tố là C và H.
Gọi công thức phân tử của B là C x H y , ta có :
4 C x H y + (4x +y) O 2 → 4x CO 2 + 2y H 2 O
n C x H y = 1,4/28 = 0,05mol
=> x = 2 ; y = 4. Công thức của B là C 2 H 4

Gọi công thức của A là C x H y O z
Đốt cháy 3 gam A được 6,6 gam CO 2 và 3,6 gam H 2 O
Vậy m C trong 3 gam A là 6,6/44 x 12 = 1,8g
m H trong 3 gam A là 3,6/18 x 2 = 0,4g
Vậy trong 3 gam A có 3 - 1,8 - 0,4 = 0,8 (gam) oxi.
Ta có quan hệ:
60 gam A → 12x gam C → y gam H → 16z gam O
3 gam A → 1,8 gam C → 0,4 gam H → 0,8 gam O
=> x = 60 x 1,8 /36 = 3 ; y = 60 x 0,4/3 = 8
z = 60 x 0,8/48 = 1
Công thức của A là C 3 H 8 O

Từ kết quả thí nghiệm cho thấy, chất trong hai mẫu thí nghiệm đều có công thức phân tử là C 3 H 8 . Vì C 3 H 8 chỉ có một công thức cấu tạo nên kết luận của phòng thí nghiệm là đúng.