Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Công thức hóa học: S x O y
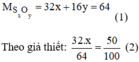
Giải phương trình (2) ta được: x = 1 thay vào pt (1) ⇒ y = 2.
Vậy công thức hóa học của oxit là S O 2

Gọi công thức hóa học của hai hợp chất lần lượt là Ax(OH)y và Ax(OH)z.
Theo thông tin cho, phần trăm khối lượng của A trong hợp chất Ax(OH)y là 50,485%. Điều này có nghĩa là 50,485g trong 100g của hợp chất đó là nguyên tố A.
Tương tự, phần trăm khối lượng của A trong hợp chất Ax(OH)z là 60,465%. Điều này có nghĩa là 60,465g trong 100g của hợp chất đó là nguyên tố A.
Với các thông tin này, ta có thể sử dụng phương pháp tính toán hóa học để xác định giá trị của x, y và z.
Đầu tiên, ta tính tỉ lệ giữa A và OH trong từng hợp chất:
Trong hợp chất Ax(OH)y, tỉ lệ A:OH là 50,485 : (100 - 50,485) = 50,485 : 49,515 (gọi là tỷ số 1)Trong hợp chất Ax(OH)z, tỉ lệ A:OH là 60,465 : (100 - 60,465) = 60,465 : 39,535 (gọi là tỷ số 2)Tiếp theo, ta xác định tỉ lệ giữa x, y và z bằng cách so sánh tỷ số 1 và tỷ số 2:
Tỷ số A:OH trong Ax(OH)y là 50,485 : 49,515 = 1,02Tỷ số A:OH trong Ax(OH)z là 60,465 : 39,535 = 1,53Do đó, ta có thể suy ra rằng tỷ số x:y trong công thức hóa học của hai hợp chất là 1,02:1,53, hoặc tương đương với 2:3.
Vậy, công thức hóa học của hai hợp chất là A2(OH)3 và A3(OH)2.

1.\(\dfrac{m_{Al}}{m_O}=\dfrac{9}{8}\)
\(Al_xO_y\)
\(x:y=\dfrac{9}{27}:\dfrac{8}{16}=\dfrac{1}{3}:\dfrac{1}{2}=2:3\)
Vậy CTHH là \(Al_2O_3\)
2.\(\rightarrow\%S=100-60=40\%\)
\(S_xO_y\)
\(x:y=\dfrac{40}{32}:\dfrac{60}{16}=1,25:3,75=1:3\)
Vậy CTHH là \(SO_3\)
3.
a.b.
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_{H_2SO_4}=2.0,2=0,4mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 < 0,4 ( mol )
0,2 0,2 0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
Chất dư là H2SO4
\(m_{H_2SO_4\left(dư\right)}=\left(0,4-0,2\right).98=19,6g\)
c.Nồng độ gì bạn nhỉ?

Viết lại đề bài bạn nhé ! Gì mà "trong cthh oxit không có oxi " ??? Oxit mà làm sao không có oxi được?

Bài 2:
\(Đặt.CTTQ.của.A:H_xS_yO_z\left(x,y,z:nguyên,dương\right)\\ Ta.có:\left\{{}\begin{matrix}x=\dfrac{98.2,04\%}{1}=2\\y=\dfrac{98.32,65\%}{32}=1\\z=\dfrac{98.\left(100\%-2,04\%-32,65\%\right)}{16}=4\end{matrix}\right.\\ \Rightarrow x=2;y=1;z=4\\ \Rightarrow CTHH:H_2SO_4\)
Bài 1: Sửa đề 59,2% Al thành 52,9% Al
\(Đặt.CTTQ:Al_xO_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{52,9\%.102}{27}\approx2\\ \Rightarrow y\approx\dfrac{\left(100\%-52,9\%\right).102}{16}\approx3\\ \Rightarrow CTHH:Al_2O_3\)
Khi phân tích 2 oxit và hai 2 hidroxit tương ứng của cùng một nguyên tố A ta được các số liệu sau đây: - Tỷ số thành... - Hoc24