Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
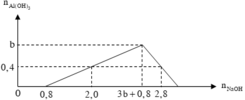
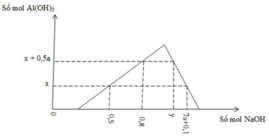
Từ đồ thị ta dễ thấy nHCl = b = 0,8 mol.
nAl3+ chưa kết tủa= 0,2 mol.
⇒ ∑nAl3+ = nAlCl3 = a = 0,4 + 0,2 = 0,6 mol.
⇒ a : b = 4 : 3

Đáp án C
Căn cứ vào bản chất phản ứng và giả thiêt, ta có đồ thị :
Suy ra :
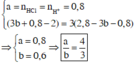

Đáp án A
Khi cho dd OH- vào hỗn hợp gồm H+ và muối Al3+
Sẽ xảy ra các phản ứng hóa học theo thứ tự sau:
OH- + H+ → H2O (1)
OH- + 3Al3+ → Al(OH)3↓ (2)
OH- + Al(OH)3↓ → AlO2- + 2H2O (3)

Giải thích:
Khi cho dd OH- vào hỗn hợp gồm H+ và muối Al3+
Sẽ xảy ra các phản ứng hóa học theo thứ tự sau:
OH- + H+ → H2O (1)
OH- + 3Al3+ → Al(OH)3↓ (2)
OH- + Al(OH)3↓ → AlO2- + 2H2O (3)
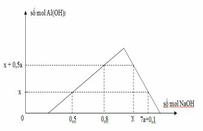
Khi phản ứng (1) kết thúc , bắt đầu xảy ra (2) thì xuất hiện kết tủa => đồ thị bắt đầu đi lên
Khi đồ thị đi lên từ từ đến điểm cực đại => xảy ra phản ứng (1) và (2)
Ta có công thức nhanh: nOH- = 3n↓ + nH+
Khi đồ thị bắt đầu đi xuống => phản ứng (3) xảy ra, kết tủa bắt đầu bị hòa tan dần dần đến hết
=> Ta có công thức tính nhanh: nOH- = 4nAl3+ - n↓ + nH+
Từ đây ta có các phương trình sau:

Đáp án A

Giải thích:
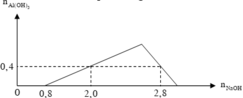
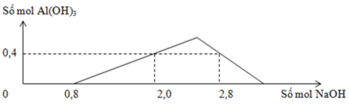
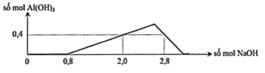
Dựa trên đồ thị :
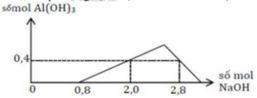
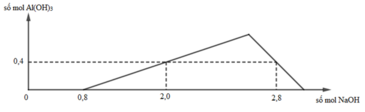
+) Tại nNaOH = 0,8 mol thì bắt đầu có kết tủa => Trung hòa vừa đủ HCl => a = 0,8 mol
+) tại nNaOH = 2,0 mol thì Al3+ còn dư => nAl(OH)3 = 0,4 mol
+) tại nNaOH = 2,8 mol thì kết tủa tan 1 phần
=> nAl(OH)3 = 4nAl3+ - (nNaOH – nHCl) => 0,4 = 4b – (2,8 – 0,8) => b = 0,6 mol
=> a : b = 0,8 : 0,6 = 4 : 3
Đáp án A

Đáp án A
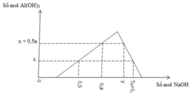
Phân tích đồ thị: gồm 3 đoạn chính.
- Đoạn ngang: O H - trung hòa .
- Đoạn xiên (1):
![]()
- Đoạn xiên (2):
![]()
Áp dụng giải quyết bài toán:
![]()
- Xét tại 2,8 mol NaOH
ta có công thức n O H - = 4 n A l 3 + - n
Với số mol O H - chỉ tính lượng phản ứng với A l 3 + v à A l ( O H ) 3
![]()

Đáp án B
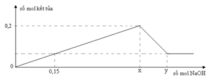
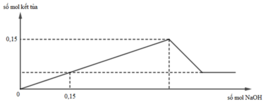
► Xét tại 0,15 mol NaOH: lượng kết tủa bằng với lúc không đổi.
||⇒ Fe(OH)3 đạt cực đại ⇒ a = 0,15 ÷ 3 = 0,05 mol.
► Khi kết tủa đạt cực đại thì: ∑n↓ = a + b = 0,15 mol ⇒ b = 0,1 mol.
||⇒ a : b = 0,05 : 0,1 = 1 : 2
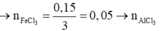
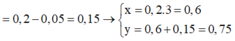
Chọn đáp án D