Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

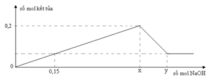
Đáp án C
Áp dụng công thức
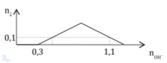
n O H - = 4 n A l 3 + - n
⇒ x = n A l ( O H ) 3 m a x = n A l 3 + = 0 , 15 m o l

Chọn đáp án C
nOH– = 4nAl3+ – n↓ ⇒ x = nAl3+ = (0,1 + 0,5) ÷ 4 = 0,15 mol ⇒ chọn C.

Giải thích:
Cho từ từ đến dư NaOH vào AlCl3 ta có:
Kết tủa cực đại khi tất cả Al3+ chuyển thành Al(OH)3
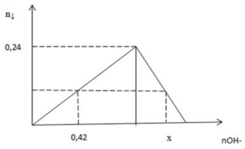
Từ đồ thị: nAl(OH)3 max = 0,24 (mol) => nAl3+ ban đầu = 0,24 (mol)
+ nOH- = 0,42 mol => chỉ tạo kết tủa Al(OH)3. Khi đó nAl(OH)3 = 1/3nOH- = 1/3. 0,42 = 0,14 (mol) (1)
+ nOH- = x mol => tạo kết tủa Al(OH)3 cực đại sau đó kết tủa Al(OH)3 tan dần đến khi còn lại đúng 1 lượng như ở (1)
Al3+ + 3OH- → Al(OH)3↓
0,14← 0,42 ← 0,14
Al3+ + 4OH- → AlO2- + H2O
(0,24- 0,14)→ 0,4
∑ nOH- = 0,42 + 0,4 = 0,82 (mol)
Đáp án A

Đáp án A
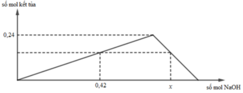
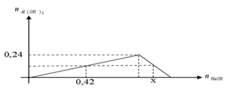
+ Khi cho 0,42 mol NaOH vào AlCl3 chưa xảy ra sự hòa tan kết tủa.
⇒ nAl(OH)3 = 0,42 : 3= 0,14 mol
+ Tại x mol NaOH thu được 0,14 mol kết tủa và xảy ra sự hòa tan kết tủa.
⇒ 4nAlCl3= nNaOH + n↓ Û x = 4. 0,24 - 0,14 = 0,82 mol

Đáp án B
Cách 1:
NaOH + HCl → NaCl + H2O
0,3 → 0,3
a = 0,3 mol
2NaOH + ZnCl2 → Zn(OH)2↓ + 2NaCl
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
![]()
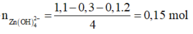
![]()
Cách 2: Phân tích đồ thị
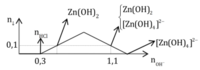
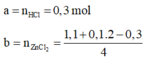
= 0,25 mol

Đáp án B
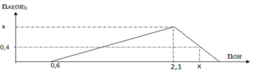
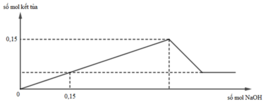
► Xét tại 0,15 mol NaOH: lượng kết tủa bằng với lúc không đổi.
||⇒ Fe(OH)3 đạt cực đại ⇒ a = 0,15 ÷ 3 = 0,05 mol.
► Khi kết tủa đạt cực đại thì: ∑n↓ = a + b = 0,15 mol ⇒ b = 0,1 mol.
||⇒ a : b = 0,05 : 0,1 = 1 : 2
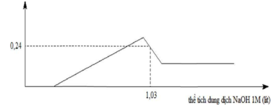
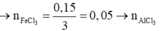
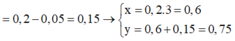
Đáp án C
Áp dụng công thức
n O H - = 4 n A l 3 + - n
⇒ x = n A l ( O H ) 3 m a x = n A l 3 + = 0 , 15 m o l