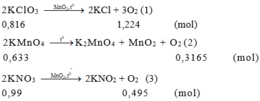Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
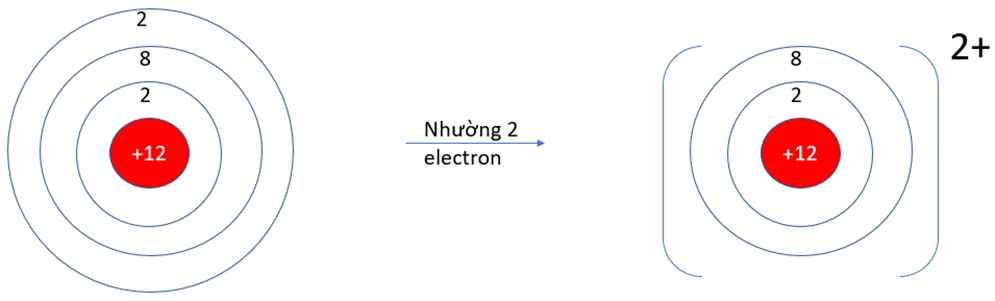
- Ở dạng nguyên tử, Na và Mg đều có 3 lớp electron. Ở dạng ion Na+, Mg2+ chỉ có 2 lớp electron
=> Bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c, Tá có:
+ Bán kính ion Na+ < bán kính ion Mg2+.
+ Điện tích ion Mg2+ < điện tích ion Na+.
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.

a) Căn cứ vào những nguyên tố mà nguyên tử của chúng có cùng số lớp electron, người ta sắp xếp thành dãy các nguyên tố gọi là chu kì (trừ chu kì 1).
Căn cứ vào cấu hình electron nguyên tử lớp ngoài cùng tương tự nhau để sắp các nguyên tố thành nhóm.
b) Chu kì là dãy những nguyên tố mà những nguyên tử của chúng có cùng số lớp electron. Chu kì nào cũng bắt đầu bằng một kim loại kiềm và kết thúc bằng một khí hiếm (trừ chu kì 1).
Bảng tuần hoàn có 7 chu kì gồm 3 chu kì nhỏ và 4 chu kì lớn.
Chu kì nhỏ là chu kì 1, 2, 3
Chu kì 1 có 2 nguyên tố.
Chu kì 2, 3 có 8 nguyên tố.
Chu kì lớn là các chu kì 4, 5, 6, 7.
Chu kì 4, 5 đều có 18 nguyên tố.
Chu kì 6 có 32 nguyên tố.
Chu kì 7 mới tìm thấy 26 nguyên tố.

Câu 3: M giải qua rồi nên t giải tắt cho lẹ :D
Thích để phân số thì t làm phân số vậy (:
\(MnO_2\left(0,02\right)+4HCl\left(đăc\right)\rightarrow MnCl_2+Cl_2\left(0,02\right)+4H_2O\)
nMnO2 = 0,02 (MOL) => nCl2 = 0,02 (mol)
\(Fe\left(a\right)+H_2SO_4\rightarrow FeSO_4+H_2\left(a\right)\)
Gọi a là số mol Fe phản ứng
Theo đề => \(56a-2a=167,4\)
\(\Rightarrow a=3,1\left(mol\right)\)=> nH2 = 3,1 (mol)
Đun nóng hoàn toàn X thì:
\(2KClO_3-t^o->2KCl+3O_2\)
=> Chất rắn còn lại là MnO2 và KCl không bị nhiệt phân
Ta có: \(\left\{{}\begin{matrix}m_{MnO_2}=3\\m_{KCl}+m_{KClO_3}=197\\m_{MnO2}+m_{KCl}=152\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}m_{MnO_2}=3\left(g\right)\\m_{KCl}=149\left(g\right)\\m_{KClO_3}=48\left(g\right)\end{matrix}\right.\)
\(\Rightarrow n_{KClO_3}=\dfrac{96}{245}\left(mol\right)\)
=> \(n_{O_2}=\dfrac{144}{245}\left(mol\right)\)
* Thí nghiệm 4:
\(O_2\left(\dfrac{144}{245}\right)+2H_2\left(\dfrac{288}{245}\right)-t^o->2H_2O\left(\dfrac{288}{245}\right)\)
\(H_2\left(0,02\right)+Cl_2\left(0,02\right)-t^o->2HCl\left(0,04\right)\)
Dung dịch Y: HCl
=> nHCl = 0,04 (mol) => mHCl = 1,46 (g)
nH2O = \(\dfrac{288}{245}\) (mol) => mH2O = \(\dfrac{5184}{245}\) (g)
\(\Rightarrow C\%_{HCl}=\dfrac{1,46.100}{\dfrac{5184}{245}+1,46}=6,45\%\)
Câu 1:
A, B lần lượt là kim loại kiềm, kiềm thổ
\(2A\left(a\right)+2HCl\rightarrow2ACl+H_2\left(0,5a\right)\)\(\left(1\right)\)
\(B\left(b\right)+2HCl\rightarrow BCl_2+H_2\left(b\right)\)\(\left(2\right)\)
\(n_{HCl}=0,5\left(mol\right)\)
\(n_{H_2}=0,78\left(mol\right)\)
Gỉa sử lượng HCl tham gia phản nứng hết
=> nH2 = 1/2nHCl = 0,25 (mol) < 0,78 (mol)
=> A, B còn dư tác dụng với nước có trong dung dịch HCl
\(2A\left(1,25x-a\right)+2H_2O\rightarrow2AOH+H_2\left(0,625x-0,5a\right)\)\(\left(3\right)\)
\(B\left(x-b\right)+2H_2O\rightarrow B\left(OH\right)_2+H_2\left(x-b\right)\)\(\left(4\right)\)
Ta có: \(nA:nB=5:4\)
Gọi x là số mol của B => nA = 1,25x (mol)
\(\Rightarrow1,25xA+xB=42,6\left(I\right)\)
Gọi a, b lần lượt là số mol của A, B ở pt (1) và (2)
Ta có: \(\sum n_{H_2}=0,78=0,5a+b+0,625x+x\)
\(\Leftrightarrow x=0,48\left(mol\right)\)
Thay vào (I) \(\Leftrightarrow0,6A+0,48B=42,6\)
- Vói A = 7 (Li) => B = 80 (loại)
- Với A = 23 (Na) => B = 60 (loại)
- Với A = 39 (K) => B = 40 (Ca) thoã mãn
- A = 85 (Rb) = > B = -17,5 (loại)
- A = 133 (Cs) => B = -77,5 (loại)
- A = 223 (Fr) = > B = -290 (loại)
Vậy A: K,
B: Ca