Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


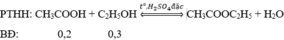
(0,2/1 < 0,3/1 nên hiệu suất tính theo axit)
Pư: 0,2h → 0,2h → 0,2h
Sau: 0,2 - 0,2h 0,3-0,2h 0,2h
=> m este = mCH3COOC2H5 = 14,08 gam
=> 0,2h.88 = 14,08 => h = 0,8 = 80%
Đáp án cần chọn là: D

Gọi n C 2 H 5 O H = x ; n C H 3 C O O H = y . Đốt cháy sản phẩm cũng như hỗn hợp ban đầu, theo định luật bảo toàn nguyên tố H ta có:
6 n C 2 H 5 O H + 4 n C H 3 C O O H = 2 n H 2 O
Hay 6x + 4y = 2. 23 , 4 18 = 2,6 (1)
Phương trình theo khối lượng: 46x + 60y = 25,8 (2)
Từ (1) và (2) suy ra: x = 0,3; y = 0,2
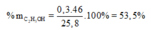
![]()
Theo lý thuyết n e s t e = n a x i t = 0 , 2
⇒ m e s t e = 17 , 6 ( g ) mà thực tế thu được 14,08 (g)
Vậy H = 14 , 08 17 , 6 . 100 % = 80 %
Đáp án D

Đáp án: D
Gọi nCH3COOH = x ; nC2H5OH = y
=> 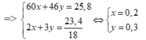
=> % CH3COOH = = 46,5% ; % C2H5OH = 53,5%
Gọi hiệu suất phản ứng este hóa là H.
=> n este = 0,2.H (vì axit hết - theo lí thuyết)
=> meste = 0,2H.88 = 17,6H
Mà meste = 14,08
=> H = 80%

Giải thích:
n H2O = 23,4 : 18 = 1,3 mol ( 1ml = 1g đối với nước )
Đặt số mol của CH3COOH là a , số mol của C2H5OH là b ta có hệ
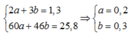
n este = 14,08 : 88 = 0,16 mol
CH3COOH + C2H5OH→ CH3COOC2H5 + H2O
0,2 0,3 => 0,2 mol ( theo lý thuyết )
![]()
Đáp án D

Chọn đáp án D
Biện pháp tăng hiệu suất của phản ứng ( tức chuyển dịch cân bằng về phía tạo thành este ) có thể lấy dư một chất trong 2 chất đầu hoặc làm giảm nồng độ các sản phẩm.
Do đó, thấy ngay các biện pháp (1), (2), (4) đúng.
Chú ý (6). đun hổi lưu là biện pháp để tăng hiệu suất sản xuất este so với các bình thường.
(5) thêm sản phẩm vào nên rõ không thỏa mãn.
(3) thêm chất xúc tác ở đây là H2SO4 đặc, hút nước mạnh → làm giảm sản phẩm H2O nên thỏa mãn.
Như vậy tổng cộng sẽ có 5 biện pháp



Đáp án D
Hỗn hợp sẽ tác làm 2 lớp, lớp ở trên không tan trong nước là este, lớp thứ 2 gồm rượu dư, axit dư và nước