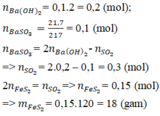Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bạn tham khảo ở đây nha:Câu hỏi của Lê Quang Hiếu - Hóa học lớp 12 | Học trực tuyến
vì K+ và Na+ nên viết p.tử không chuẩn
a) khi cho H+ từ từ vào CO32- và HCO3- thì H+ td với CO32- trước vì nộng độ H+trong dd mới tạo thành nhỏ nên sẽ tác dụng từng nấc(vì chỉ từng giọt).lượng H+ chưa dư khi tác dụng với CO32- nên không thể tác dụng tiếp với HCO3- dẫn đến không có hiện tượng
H++CO32- -->HCO3-
b) khi cho H+ từ từ vào CO32- và HCO3- thì H+ td với CO32- trước. H+ tác dụng với CO32- còn dư tác dụng với 1 phần HCO3- tạo CO2 khí ko màu dd còn HCO3- tác dụng với OH- tạo CO32- td Ba2+ tạo kt trắng BaCO3
CO32-+H+-->HCO3-
HCO3-+H+-->H2O+CO2
HCO3-+OH-+Ba2+-->BaCO3+H2O(dư nên khi vậy ko dư ghi tỉ lệ Ba2+:OH-=1:2)
c)cho từ từ CO32- và HCO3- vào H+ thì pứ xảy ra đồng thời tạo đều tạo khí CO2 vì khi cho vào thì mt có nồng độ H+ lớn nên pứ xảy ra theo 2 nấc đồng thời
CO32-+2H+-->H2O+CO2
HCO3-+H+-->H2O+CO2

Ta thấy khi cho Br 2 vào dung dịch 2 muối S 4 + thì toàn bộ S 4 + sẽ bị oxi hoá lên S 6 + ( SO 4 2 - )do đó :
n SO 2 = n SO 4 2 - = 0,15
=> m BaSO 4 = 0,15.233 = 34,95g

Gọi \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
PTHH:
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
a------------------------------->a
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
b----------------------------------->0,5b
\(2NaOH+CuSO_4\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
a---------->a
\(6NaOH+Fe_2\left(SO_4\right)_3\rightarrow2Fe\left(OH\right)_3\downarrow+3Na_2SO_4\)
0,5b----------->a
Theo bài ra, ta có hệ: \(\left\{{}\begin{matrix}160a+400.0,5b=71,2\\98a+107b=40,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,17\left(mol\right)\\b=0,22\left(mol\right)\end{matrix}\right.\left(TM\right)\)
\(\rightarrow m=0,17.64+0,22.56=23,2\left(g\right)\)

Đáp án C.
nBa(OH)2= 0,1.2 = 0,2 (mol); nBaSO3 = 0,1 (mol)
nBaSO3 = 2 nBa(OH)2 - nSO2 ⇒ nSO2 = 2.0,2 – 0,1 = 0,3 (mol)
FeS2 → 2SO2 (Bảo toàn S)
0,15 0,3 (mol)
⇒ mFeS2 = 0,15.(56+32.2) = 18 (g)