Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Công thức oxit cao nhất là RO2
Có \(\dfrac{32}{M_R+32}.100\%=53,3\%=>M_R=28\left(Si\right)\)

Hợp chất khí với hidro của một nguyên tố là RH4, theo bảng tuần hoàn suy ra công thức oxit cao nhất của R là RO2, trong phân tử RO2 có 53,3% oxit về khối lượng nên R có 100% - 53,3% = 46,7% về khối lượng.
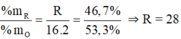
Vậy R là Si. Công thức phân tử là SiH4 và SiO2.

Gọi CTHH của R với oxi là: R2O3
Theo đề, ta có: \(\%_{O_{\left(R_2O_3\right)}}=\dfrac{16.3}{NTK_R.2+16.3}.100\%=56,34\%\)
=> \(NTK_R\approx19\left(đvC\right)\)
=> R là flo (F)
=> CTHH của R và H là: FH3
CTHH của R và O là: F2O3

Đáp án B
Công thức hợp chất khí với hiđro là RH4 => Hóa trị của R trong hợp chất khí với hiđro là 4 => Hóa trị
của R trong oxit cao nhất = 8 - 4 = 4 =>Công thức oxit cao nhất là RO2
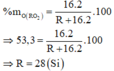
R là Si(silic)





vì R có hợp chất với hidro là \(RH_4\)
\(\rightarrow\)R có hóa trị IV vậy oxit cao nhất của R với oxi là RO2
M\(_{O_2}=16.2=32\left(g\right)\Rightarrow M_{RO_2}=\dfrac{32.100}{53,3}\approx60\left(g\right)\)
\(\Rightarrow M_R=60-32=28\left(g\right)\)
vậy R là Ni(Niken)
k z