Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hợp chất hữu cơ gồm hai loại chính là:
A. Hidrocacbon và dẫn xuất của hidrocacbon
B. Loại trong phân tử chỉ có 2 nguyên tố cacbon, hidro và loại trong phân tử ngoài 2 nguyên tố cacbon, hidro còn có nguyên tố khác.
C. Loại có trong cơ thể người và loại không có trong cơ thể người.
D. Loại tan trong nước và loại không tan trong nước.

(a) Phản ứng nổ của TNT: 2C7H5N3O6 → 3N2 + 5H2O + 7CO + 7C
(b) 100 gam thuốc nổ Hexanit có chứa 60 gam TNT và 40 gam HND.
Số mol của từng chất là:
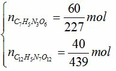
Áp dụng định luật bảo toàn nguyên tố ta có:
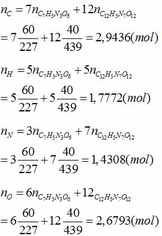
- Phần trăm khối lượng mỗi nguyên tố trong Hexanit:
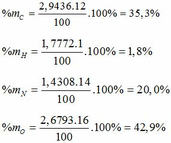
- Sản phẩm nổ của Hexanit là N2, H2O, CO, C
- Áp dụng định luật bảo toàn nguyên tố ta tính được số mol của các chất trong hỗn hợp sau khi nổ:
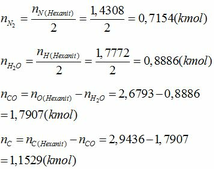
Phần trăm số mol của các chất trong hỗn hợp sau khi nổ:
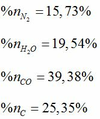

Gọi số hạt proton = số hạt electron = p
Gọi số hạt notron = n
Ta có :
2p + n = 42 ⇒ n = 42 - 2p
Mặt khác :
p ≤ n ≤ 1,5p
⇒ p ≤ 42 - 2p ≤ 1,5p
⇒ 12 ≤ p ≤ 14
Với p = 12 suy ra R là Magie thì n = 42 - 12.2 = 18(Loại vì Mg có 12 hạt notron)
Với p = 13 suy ra R là Nhôm thì n = 42 -13.2 = 16(Loại vì Nhôm có 13 hạt notron)
Với p = 14 suy ra R là Silic thì n = 42 - 14.2 = 14(Thỏa mãn)
Nguyên tử khối = p + n = 14 + 14 = 28

Chọn D
(1) Sai :(N H 4 ) 2 S O 4 chứa nguyên tố N nên dùng để cung cấp phân đạm cho cây, không chứa Photpho → không dùng để cung cấp phân lân
(2) Đúng: Phần trăm khối lượng N có trong phân hóa học là:
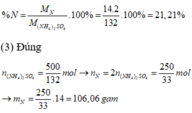
(4) Sai vì phân này tan hoàn toàn trong nước
(5) Sai vì phân ure (N H 2 ) 2 CO có hàm lượng N cao hơn phân (N H 4 ) 2 S O 4
→ thay ure bằng phân này sẽ giảm hàm lượng nguyên tố dinh dưỡng
→ ít lợi hơn
Vậy có 2 phát biểu đúng

Theo đề bài: cho A phản ứng với dung dịch NaOH thu được glixerol và 2 muối của 2 axit đơn chức, A chỉ chứa 1 loại nhóm chức
=> A là este 3 chức phản ứng với NaOH theo tỷ lệ mol 1:3 tạo ra 0,02 mol glixerol nên tiêu thụ 0,06 mol NaOH, tạo ra 0,04 mol 1 muối và 0,02 mol muối còn lại.
A + 3NaOH → C3H5(OH)3 + 2R1COONa + R2COONa
0,06 ← 0,02 → 0,04 → 0,02
=> nNaOH dư = 0,025.4 – 0,06 = 0,04 mol
Ta lại có: Axit X ít hơn Y 2 nguyên tử C và có cùng số nguyên tử H.
=> Gọi CTPT của các muối của X, Y với số mol tương ứng là CnHmCOONa x mol và Cn+2HmCOONa y mol.
Bảo toàn Na ta có:
nNa2CO3 = 1/2nNaOH bđ = 0,05 mol
Dẫn hỗn hợp khí và hơi sau khi đốt cháy B vào dung dịch Ba(OH)2 dư thì xảy ra phản ứng: Ba(OH)2 + CO2 → BaCO3 + H2O
=> nCO2 = nBaCO3 = 195,03/197 = 0,99 mol
Bảo toàn C ta có (n+1)x + (n+3)y = 0,05 + 0,99 =1,04 (*)
Xét 2 trường hợp có thể có với este A.
Trường hợp 1: A chứa 2 gốc axit X và 1 gốc axit Y
=> x = 0,04 mol, y = 0,02 thay vào (*) thì n = 15,67 vô lí (loại).
Trường hợp 2: A chứa 2 gốc axit Y và 1 gốc axit X
=> x = 0,02 mol, y = 0,04 mol thay vào (*) thì n =15
Khi đó 19,24 gam hỗn hợp B gồm: C15HmCOONa 0,02 mol, C17HmCOONa 0,04 mol và NaOH dư 0,04 mol.
=> 0,02(247 + m) + 0,04(271 + m) + 0,04 . 40 = 19,24
=> m = 31 (thỏa mãn)
=> 2 muối thu được là C15H31COONa và C17H31COONa
Este A có dạng:
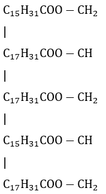
CTPT của A là C55H98O6

gọi công thức phân tử của hợp chất hữu cơ A là CXHYOZ
Ta có : %O =100-(60+ 13.33)=26.63%
Ta có ;
\(\frac{12x}{60}\)=\(\frac{y}{13.33}\)=\(\frac{16z}{26.67}\)=\(\frac{60}{100}\)= 0.6
do đó : x=\(\frac{60.0,6}{12}\)=3
y=0,6.13,33=8
z=\(\frac{26,67.0,6}{16}\)=1
vậy công thức phân tử của A là C3H8O.

R là Cu
X1 là CuO, X2 là CuSO4, X3 là Cu(NO3)2, X4 là Cu(OH)2
PTHH:
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
\(CuO+2HNO_3\rightarrow Cu\left(NO_3\right)_2+H_2O\)
\(Cu+4HNO_{3\left(đ\right)}\rightarrow Cu\left(NO_3\right)_2+2NO_2+2H_2O\)




Đáp án A
Hợp chất hữu cơ gồm 2 loại chính là hidrocacbon và dẫn xuất của hidrocacbon