Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Tổng số hạt trong phân tử Y là 214 hạt.
4(2pM + nM) + 3(2pX + nX) = 214 (1)
Ion M3+ có số electron bằng số electron của ion X4 −
pM - 3 = pX + 4 => pX = pM - 7 (2)
Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố M nhiều hơn tổng số hạt của nguyên tử nguyên tố X trong Y là 106
4(2pM + nM) - 3(2pX + nX) = 106 (3)
(1), (3) => 2pM + nM = 40 (4) và 2pX + nX = 18 (5)
(5),(2),(4) => pX = 6 ; pM = 13 => X là C (Carbon) và M là Al (Nhôm)
Y la Al4C3 (Nhôm carbua)

Ta có: P = E (Do nguyên tử trung hòa về điện)
- Trong MX3 có tổng số hạt p, e, n là 196.
⇒ 2PM + NM + 3.2PX + 3NX = 196 (1)
- Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 60.
⇒ 2PM + 3.2PX - NM - 3NX = 60 (2)
- Khối lượng nguyên tử X lớn hơn M là 8.
⇒ PX + NX - PM - NM = 8 (3)
- Tổng số hạt trong X- nhiều hơn trong M3+ là 16.
⇒ 2PX + NX + 1 - (2PM + NM - 3) = 16 (4)
Từ (1), (2), (3) và (4) \(\Rightarrow\left\{{}\begin{matrix}P_M=13=Z_M\\N_M=14\\P_X=17=Z_X\\N_X=18\end{matrix}\right.\)
→ M là Al, X là Cl.
Vậy: CTHH cần tìm là AlCl3.

1/Đặt Z, N lần lượt là số hạt p, n có trong nguyên tử M
ta có hệ phương trình
\(\begin{cases}2Z+N=79+3\\2Z-N=19+3\end{cases}\)\(\Rightarrow\begin{cases}Z=26\\N=30\end{cases}\)
a. Cấu hình electron nguyên tử của M là: 1s22s22p63s23p63d64s2
M ở ô thứ 26, chu kì 4 nhóm VIIIB trong bảng tuần hoàn.
b. Cấu hình electron của ion Fe2+ là: 1s22s22p63s23p63d6
Cấu hình electron của ion Fe3+ là: 1s22s22p63s23p63d5
2.
Vì R tạo được hợp chất khí với H nên R là phi kim.
Giả sử R thuộc nhóm x (x\(\ge\)4).
Theo giả thiết
công thức của R với H là RH8-x \(\Rightarrow\)a=\(\frac{R}{R+8-x}.100\)
công thức oxit cao nhất của R là R2Ox
\(\Rightarrow\) b=\(\frac{2R}{2R+16x}.100\) \(\Leftrightarrow\) b= \(\frac{R}{R+8x}.100\)
suy ra \(\frac{a}{b}=\frac{R+8x}{R+8-x}=\frac{11}{4}\)\(\Leftrightarrow R=\frac{43x-88}{7}\)
Xét bảng
a/ Vậy R là C
b/
Công thức của R với H là CH4
Công thức electron ; Công thức cấu tạo
Oxti cao nhất của R là CO2
Công thức electron O:: C ::O; Công thức cấu tạo O=C=O
c.
Trong hợp chất CH4 có \(\Delta\chi=\chi_C-\chi_H\)=2,55-0,22=0,35<0,4 nên liên kết giữa C-H là liên kết cộng hóa trị không cực
Trong hợp chất CO2 có 0, \(\Delta\chi=\chi_O-\chi_C\) =3,44-2,55=0,89
\(\Rightarrow\) 0,4<\(\Delta\chi=0,89\)<1,7 nên liên kết giữa C=O là liên kết cộng hóa trị phân cực

Ta có: P + N + E = 18
Mà: P = E (do nguyên tử trung hòa về điện)
⇒ 2P + N = 18 ⇒ N = 18 - 2P
Luôn có: \(1\le\dfrac{N}{P}\le1,5\) \(\Rightarrow P\le18-2P\le1,5P\)
\(\Rightarrow5,14\le P\le6\)
⇒ P = E = 6
N = 6

Đáp án C
Tổng số proton trong MX2 là 58 hạt
→ ZM + 2.ZX = 58
Trong hạt nhân M có số notron nhiều hơn số hạt proton là 4 hạt
→ -ZM + NM = 4
Trong hạt nhân X, số notron bằng số proton → ZX = NX
MA =ZM + NM + 2.ZX + 2.NX
= (ZM + 2.ZX ) + NM + 2NX
= 58 + NM + 58 - ZM = 116 + NM- ZM
M chiếm 46,67% về khối lượng
![]()
![]()
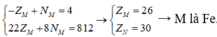
![]()
Cấu hình electron của M là [Ar]3d64s2.

Ta có: P = E (Do nguyên tử trung hòa về điện)
- Tổng số p, e, e trong A và B là 142.
⇒ 2PA + NA + 2PB + NB = 142 (1)
- Tổng số hạt mang điện nhiều hơn số hạt không mang điện là 42.
⇒ 2PA + 2PB - NA - NB = 42 ⇒ NA + NB = 2PA + 2PB - 42 (2)
Thay (2) vào (1), được 4PA + 4PB = 184 (*)
- Số hạt mang điện của B nhiều hơn của A là 12.
⇒ 2PA - 2PB = 12 (**)
Từ (*) và (**) \(\Rightarrow\left\{{}\begin{matrix}P_A=26=Z_A\\P_B=20=Z_B\end{matrix}\right.\)
Vậy: Số hiệu nguyên tử của A và B lần lượt là 26 và 20.

a, Ta có: P = E (Do nguyên tử trung hòa về điện.)
- Trong MX2, M chiếm 46,67% về khối lượng.
\(\Rightarrow\dfrac{2P_M+N_M}{2P_M+N_M+2.2P_X+2N_X}=0,4667\left(1\right)\)
- Trong hạt nhân M, số n nhiều hơn số p là 4 hạt.
⇒ NM - PM = 4 (2)
- Trong hạt nhân X, số n bằng số p.
⇒ NX = PX (3)
- Tổng số p trong MX2 là 58.
⇒ PM + 2PX = 58 (4)
Từ (1), (2), (3) và (4) \(\left\{{}\begin{matrix}P_M=26\\N_M=30\\P_X=16\\N_X=16\end{matrix}\right.\)
⇒ AM = 26 + 30 = 56
AX = 16 + 16 = 32
b, M là Fe, X là S.
Vậy: CTPT cần tìm là FeS2.
a, Ta có: P = E (Do nguyên tử trung hòa về điện)
- Tổng số hạt p, n, e trong A là 214.
⇒ 4.2PM + 4NM + 3.2PX + 3NX = 214 (1)
- Tổng số hạt p, n, e của [M]4 nhiều hơn so với [X]3 trong A là 106.
⇒ 4.2PM + 4NM - 3.2PX - 3NX = 106 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}2P_M+N_M=40\\2P_X+N_X=18\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}N_M=40-2P_M\\N_X=18-2P_X\end{matrix}\right.\)
Luôn có: \(1\le\dfrac{N}{P}\le1,5\)
\(\Rightarrow\left\{{}\begin{matrix}P_M\le40-2P_M\le1,5P_M\\P_X\le18-2P_X\le1,5P_X\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}11,4\le P_M\le13,3\\5,1\le P_X\le6\end{matrix}\right.\)
⇒ PM = 12 (Mg) hoặc PM = 13 (Al)
PX = 6 (C)
Mà: A có CTHH dạng M4X3 nên A là Al4C3.
b, Al: 1s22s22p63s23p1
C: 1s22s22p2