K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

11 tháng 11 2018
TBR:
MN=14,16⋅11,864%≈1,68(gam)14,16⋅11,864%≈1,68(gam)
=> nN=1,68:14=0,12(mol)
=> nNO3=nN=0,12(mol)nNO3=nN=0,12(mol)
=> mkim loại=mX−mNO3mX−mNO3=14,16-0,12.62=6,72(gam)
Vậy......

11 tháng 11 2018
TBR:
MN=14,16⋅11,864%≈1,68(gam)14,16⋅11,864%≈1,68(gam)
=> nN=1,68:14=0,12(mol)
=> nNO3=nN=0,12(mol)nNO3=nN=0,12(mol)
=> mkim loại=mX−mNO3mX−mNO3=14,16-0,12.62=6,72(gam)
Vậy......

B
27 tháng 2 2020
Cho 3,07 gam hỗn hợp bột kim loại X gồm Al và Fe [đã giải] – Học Hóa Online
27 tháng 2 2020
Em có lên trang này xem rồi mà không hiểu nên mới hỏi trên h24 mà....

BV
11 tháng 8 2021
nH2= 0,12 mol
Fe + 2HCl = FeCl2 + H2
=> nFe = nH2 = 0,12 mol
=> mFe = 0,12*56 = 6,72 gam
=%Fe = (6,72*100%):10 = 67,2%
=> % Cu = 100% -67,2% = 32,8%
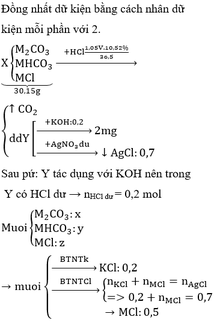
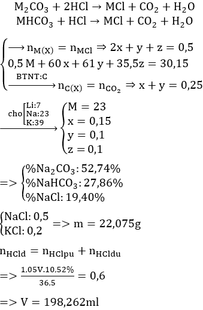
TBR:
MN=\(14,16\cdot11,864\%\approx1,68\left(gam\right)\)
=> nN=1,68:14=0,12(mol)
=> \(n_{NO_3}=n_N=0,12\left(mol\right)\)
=> mkim loại=\(m_X-m_{NO_3}\)=14,16-0,12.62=6,72(gam)
Vậy......