Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Định hướng tư duy giải
→ n NH 4 + = 0 , 235 . 2 - 0 , 14 . 3 8 = 0 , 00625
=> 110,23 = 0,73943m + 96.(0,235+0,26057m/16) => m = 38,07
=> mY = 28,15 + 62.(0,00625.8 + 0,14.3 + 0,62.2) + 80.0,00625 = 134,67

Chọn A.
→ B T : e c h o 1 v à 2 n N H 4 N O 3 = 2 n S O 2 - 3 n N O - 8 n N 2 O 8 = 0 , 0375 m o l
Gọi T là hỗn hợp muối chứa Fe(NO3)2 và Mg(NO3)2 suy ra: m T = m Y - m N H 4 N O 3 = 126 , 4 g a m
Áp dụng phương pháp tăng giảm khối lượng + bảo toàn điện tích cho hỗn hợp T và Z ta có:


Đáp án B
Sau khi hỗn hợp X bị CO lấy
đi 1 phần oxi ⇒ Chất rắn Y.
+ Đặt nFe/Y = a và nO/Y = b ta có:
PT bảo toàn electron:
3a – 2b = 2nSO2 = 0,09 mol (1)
PT theo muối Fe2(SO4)3:
200a = 18 (2)
+ Giải hệ (1) và (2) ta có:
a = b = 0,09 mol
⇒ mY = 0,09(56+16) = 6,48 gam.
+ Mà nO bị lấy đi bởi CO = nCaCO3 = 0,04 mol
⇒ nX = mY + mO bị lấy đi
= 6,48 + 0,04×16 = 7,12 gam




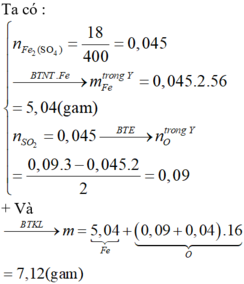
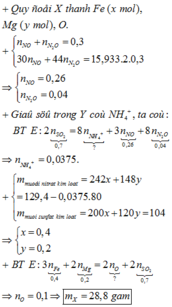





Đáp án A
Quy hỗn hợp X về dạng Fe và O.
=> mX = 56nFe + 16nO = 14,4g (1)
- Khi X + H2SO4: Bảo toàn e: 3nFe = 2nO + 2nSO2
=> 3nFe – 2nO = 2.6,72: 22,4 = 0,6 mol (2)
Từ (1,2) => nFe = 0,24; nO = 0,06 mol
Vậy muối trong dung dịch sau phản ứng sẽ là: 0,12 mol Fe2(SO4)3
=> mFe2(SO4)3 = 0,12.400 = 48g