Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
hhX gồm H2 và C2H4 có dX/He = 3,75.
Dẫn X qua Ni, to → hhY có dY/He = 5.
• Đặt nH2 = x mol; nC2H4 = y mol.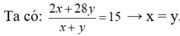
Đặt nH2 = 1 mol; nC2H4 = 1 mol.
Giả sử có x mol C2H6 tạo thành → hhY gồm C2H6 x mol; H2 (1 - x) mol và C2H4 (1 - x) mol.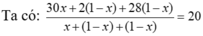
→ x = 0,5 → H = 50%

Đáp án C
Hướng dẫn
Áp dụng sơ đồ đường chéo ta có :
n H 2 n C 2 H 4 = 28 - 15 15 - 2 = 1 1 Þ Có thể tính hiệu suất phản ứng theo H2 hoặc theo C2H4
Phương trình phản ứng :
H2 + C2H4 ![]() C2H6
C2H6
Áp dụng định luật bảo toàn khối lượng ta có :
mX = mY <=> nX. M - X = nY. M - Y <=> n X n Y = M - Y M _ X = 5 . 4 3 , 75 . 4 = 4 3
Chọn nX = 4 mol => n H 2 = n C 2 H 4 = 2 mol ; n H 2 ( p o ) . . = n X - n Y = 1 mol
=> Hiệu suất phản ứng : H = 1 2 .100% = 50%

Đáp án C
Hướng dẫn Ta có : M - X = 4. 3,75 = 15
C 2 H 4 28 13 \ / 15 / \ H 2 2 13
→ n C 2 H 4 n H 2 = 1 1
Vậy hiệu suất tính theo anken hoặc H2 củng được
Giả sử: nX = 1mol → mX = 15. 1 = 15 g = mY
Mà M - Y = 5. 4 = 20 → nY = 15/20 = 0,75 mol → nH2 pư = 1 – 0,75 = 0,25 mol
→ H = 0 , 25 0 , 5 .100% = 50%

Đáp án C
Hướng dẫn
Ta có : M - X = 4. 3,75 = 15
C 2 H 4 28 13 \ / 15 / \ H 2 2 13
→ n C 2 H n H 2 = 1 1
Vậy hiệu suất tính theo anken hoặc H2 củng được
Giả sử: nX = 1mol à mX = 15. 1 = 15 g = mY
Mà M - Y = 5. 4 = 20 à nY = 15/20 = 0,75 mol à nH2 pư= 1 – 0,75 = 0,25 mol
à H = 0 , 25 0 , 5 .100% = 50%

n1 là số mol hỗn hợp khí ban đầu, n2 là số mol hỗn hợp khí sau phản ứng.

Đáp án C
Giả sử hỗn hợp X chứa 1 mol → nH2 = 0,8 mol, nC2H2 = 0,2 mol
Luôn có mX = mY → nY =
1
.
3
,
6
.
2
4
.
2
= 0,9 mol
Nhận thấy nH2 pu = nC2H4 pu = nX - nY = 1- 0,9 = 0,1 mol
→ H = 0 , 1 0 , 2 ×100% = 50%.

Đáp án D
hhX gồm H2 và C2H4 có dX/H2 = 7,5.
Dẫn X qua Ni, to → hhY có dY/H2 = 12,5.
• Đặt nH2 = x mol; nC2H4 = y mol.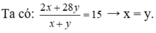
Đặt nH2 = 1 mol; nC2H4 = 1 mol.
Giả sử có x mol C2H6 tạo thành → hhY gồm C2H6 x mol; H2 (1 - x) mol và C2H4 (1 - x) mol.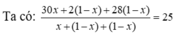
→ x = 0,8 → H = 80%


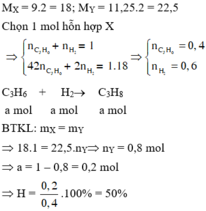
Giả sử nX =1
Có nH2 + nC2H4 = nX = 1
2nH2 + 28nC2H4 = mX = 3,75.4 = 15
⇒ nH2 = nC2H4 = 0,5
Đặt nC2H4 phản ứng = a ⇒ nH2 phản ứng = a.
⇒ nY = nX – nH2 phản ứng = 1 – a
MY = 5.4 =20
mY = mX =15 ⇒ nY = 15 : 20 =0,75 ⇒ a = 1- 0,75 = 0,25
⇒ H = 25%
Đáp án B.