Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol của CH 4 trong hỗn hợp là X, của C 2 H 4 trong hỗn hợp là y.
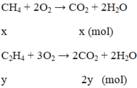
Ta có hệ: x + y = 0,15 mol và y = x + 2y = n CO 2 = n CaCO 3 = 0,2 mol
⇒ x = 0,1; y = 0,05
⇒ % V C H 4 = 66,67% ; % V C 2 H 4 = 33,33%.

a)
$CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
$C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O$
$CO_2 + Ba(OH)_2 \to BaCO_3 + H_2O$
b)
Gọi $n_{CH_4} = a(mol) ; n_{C_2H_4} = b(mol)$
$\Rightarorw a + b = \dfrac{1,68}{22,4} = 0,075(1)$
Theo PTHH : $n_{BaCO_3} = n_{CO_2} = a + 2b = \dfrac{19,7}{197} = 0,1(2)$
Từ (1)(2) suy ra : a = 0,05 ; b = 0,025
$\%V_{CH_4} = \dfrac{0,05}{0,075}.100\% = 66,67\%$
$\%V_{C_2H_4} = 100\% - 66,67\% = 33,33\%$
c) $n_{O_2} = 2n_{CH_4} + 3n_{C_2H_4} = 0,175(mol)$
$\Rightarrow V_{O_2} = 0,175.22,4 = 3,92(lít)$
$\Rightarrow V_{kk} = 5V_{O_2} = 19,6(lít)$

\(Đặt:n_{CH_4}=a\left(mol\right),n_{C_2H_2}=b\left(mol\right)\)
\(n_{hh}=a+b=0.35\left(mol\right)\left(1\right)\)
\(BTC:\)
\(a+2b=0.6\)
\(a=1\)
\(b=0.25\)
\(\%CH_4=\dfrac{0.1}{0.35}\cdot100\%=28.57\%\)
\(\%C_2H_2=71.43\%\)
\(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_2}=y\left(mol\right)\end{matrix}\right.\)⇒ x + y = \(\dfrac{7,84}{22,4} = 0,35(mol)\)
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ C_2H_2 + \dfrac{5}{2}O_2 \xrightarrow{t^o} 2CO_2 + H_2O\\ CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\)
Theo PTHH : x + 2y = \(\dfrac{60}{100} = 0,6(2)\)
Từ (1)(2) suy ra x = 0,1 ; y = 0,25
Vậy :
\(\%V_{CH_4} = \dfrac{0,1}{0,35}.100\% = 28,57\%\\ \%V_{C_2H_2} = 100\% - 28,57\% = 71,43\%\)

Gọi số mol của CH4 và C2H2 lần lượt là a và b
CH4 + 2O2 ➝ CO2 + 2H2O
a 2a a
C2H2 + 2,5O2 ➝ 2CO2 + H2O
b 2,5b 2b
CO2 + Ca(OH)2 ➝ CaCO3 + H2O
a + 2b a + 2b
Số mol của hỗn hợp khí: a + b = 4,48/22,4 = 0,2 mol
Số mol kết tủa: a + 2b = 30/100 = 0,3 mol
➝ a = 0,1 mol, b = 0,1 mol
a) %VC2H2 = %VCH4 = 50%
b) Tổng số mol khí O2 đã dùng: a + 2,5b = 0,35 mol
➝ VO2 = 0,35.22,4 = 7,84 lít
➝ V kk = 5.VO2 = 39,2 lít

a) Gọi số mol CH4, C2H2 là a, b (mol)
=> \(a+b=\dfrac{4,48}{22,4}=0,2\) (1)
\(n_{CaCO_3}=\dfrac{30}{100}=0,3\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a--->2a----------->a
2C2H2 + 5O2 --to--> 4CO2 + 2H2O
b------>2,5b-------->2b
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,3<-----0,3
=> a + 2b = 0,3 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> \(\%V_{CH_4}=\%V_{C_2H_2}=\dfrac{0,1}{0,2}.100\%=50\%\)
b) nO2 = 2a + 2,5b = 0,45 (mol)
=> VO2 = 0,45.22,4 = 10,08 (l)
=> Vkk = 10,08.5 = 50,4 (l)

\(n_{hhk}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
`->` Khí thoát ra là CH4
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,2 0,2 ( mol )
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,2 0,2 ( mol )
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
\(\%V_{CH_4}=\dfrac{0,2}{0,3}.100=66,67\%\)
\(\%V_{C_2H_4}=100-66,67=33,33\%\)

Theo gt ta có: $n_{O_2}=0,6(mol);n_{hh}=0,25(mol)$
a, $CH_4+2O_2\rightarrow CO_2+2H_2O$
$C_2H_4+3O_2\rightarrow 2CO_2+2H_2O$
Gọi số mol CH4 và C2H4 lần lượt là a;b(mol)
Ta có: $a+b=0,25;2a+3b=0,6\Rightarrow a=0,15;b=0,1$
b, Suy ra $\%V_{CH_4}=60\%;\%V_{C_2H_4}=40\%$
c, Ta có: $n_{CaCO_3}=n_{CO_2}=0,15+0,1.2=0,35(mol)\Rightarrow m_{CaCO_3}=35(g)$
\(a)\\ CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O\\ b)\ V_{CH_4} = a(lít) ; V_{C_2H_4} = b(lít)\\ \Rightarrow a + b = 5,6(1)\\ V_{O_2} = 2a + 3b = 13,44(2)\\ (1)(2)\Rightarrow a = 3,36 ; b = 2,24\\ \%V_{CH_4} = \dfrac{3,36}{5,6}.100\% = 60\%\\ \%V_{C_2H_4} = 40\%\\ c) V_{CO_2} = a + 2b = 7,84(lít)\\\)
\(CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CaCO_3} = n_{CO_2} = \dfrac{7,84}{22,4} = 0,35(mol)\\ \Rightarrow m_{CaCO_3} = 0,35.100 = 35(gam)\)


\(CH_4+CO_2\rightarrow CO_2+2H_2O\)
\(C_2H_4+3O_2\rightarrow2CO_2+2H_2O\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
Ta có :
\(n_{hh}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{CO2}=n_{CaCO3}=\frac{30}{100}=0,3\left(mol\right)\)
Gọi a là số mol CH4 b là số mol C2H4
Giải hệ PT
\(\left\{{}\begin{matrix}a+b=0,2\\a+2b=0,3\end{matrix}\right.\Rightarrow a=b=0,1\)
\(\%V_{C2H4}=\%V_{CH4}=50\%\)