Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Hướng dẫn Gọi số mol oxit MO = x mol
MO + H2SO4 ® MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu = ![]() = 560x (gam)
= 560x (gam)
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x
Theo bài: C% (MSO4) = 20% nên: ![]()
Từ đây tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO

Đáp án B
Hướng dẫn
Gọi số mol oxit MO = x mol.
MO + H2SO4 → MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu ![]() = 560x (gam)
= 560x (gam)
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x.
Theo bài: C% (MSO4) = 20% nên: ![]()
Từ đây ta tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO

Đáp án A.
Coi nH2SO4 = 1 mol
M(OH)2 + H2SO4 → MSO4 + 2H2O
mdd H2SO4= 1.98.100/20 = 490 (gam)
=> mdd sau = (M + 34) + 490 = M + 524


- Giả sử khối lượng dung dịch axit là 100 g .
=> nH2SO4 = 0,05 ( mol )
\(R_2O_n+nH_2SO_4\rightarrow R_2\left(SO_4\right)_n+nH_2O\)
.0,05/n......0,05.............0,05/n.......0,05.............
=> mddsau = \(100+\dfrac{0,05}{n}\left(2R+16n\right)=100,8+\dfrac{R}{10n}\left(g\right)\)
=> \(5,882\%=\dfrac{\dfrac{0,05}{n}\left(2R+96n\right)}{100,8+\dfrac{R}{10n}}.100\%\)
=> \(R=11,99617501n\)
Lập bảng giá trị ta được : ( R; n ) = ( ~24; 2 ) TM .
Vậy công thức oxit là MgO .

Đặt kim loại là M, oxit là MO
Giả sử có 1 mol MO phản ứng, 1 mol H2SO4 phản ứng:
MO + H2SO4---- -> MSO4 + H2O
C% = mct / mdd . 100%
10% = 1 . 98 / mdd . 100%
-> mDd H2SO4 = 980 g
Theo định luật bảo toàn khối lượng ta có:
Mdd = mMO + mddH2SO4 = (M + 16) + 980
= M + 996
C%muối = m chất tan muối/ m dd muối . 100%
15.17% = \(\frac{M+96}{M+996}\). 100%
=>M = 64.95 g
=>M là Zn
Công thức oxit ZnO
đặt kim loại là m , oxit là mo
giả sử có 1 mol mo phản ứng , 1 mol h2so4 phản ứng
mo+ h2so4 ---> mso4 +h2o
c% =mct / mdd .100%
10%= 1.98/mdd.100%
---> mdd h2so4 =980g
theo định luât bảo toàn khối lượng ta có
mdd = m mo + mdd h2so4 =( m+16) +980 = m +996
c% muối = m chất tan muối / m dd muối .100%
15.17% =( m=96)/ ( m+ 996) * 100%
m= 64.95g
m là zn
công thức oxit zno

Giả sử số mol của MO là 1 mol
Pt: \(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
1 ----------> 1---------> 1 -----------> 1
\(m_{dd\left(spu\right)}=M+16+\dfrac{98.100}{17,5}=M+576\left(g\right)\)
\(C\%_{MSO_4}=\dfrac{M+96}{M+576}.100=20\%\)
=> M = 24 => M là Mg

Câu 5
Gọi kim loại là M, oxit là MO
Giả sử có 1 mol MO phản ứng, 1 mol H2SO4 phản ứng:
MO + H2SO4 -> MSO4 + H2O
C% = \(\frac{m_{ct}}{m_{dd}}\) . 100%
10% = \(\frac{98}{mdd}\) . 100%
-> mDd H2SO4 = 980 g
Theo định luật bảo toàn khối lượng ta có:
Mdd = mMO + mddH2SO4 = (M + 16) + 980
= M + 996
C%muối = m chất tan muối/ m dd muối . 100%
15.17% = (M + 96) / (M + 996) .100%
M = 64.95 g
M là Zn
Công thức oxit ZnO
#tham khảo nhưng mình đã sửa lại cho dễ hiểu rồi nhé
Câu 4:
\(\text{Gọi công thức chung của 2 kim loại kiềm là X}\)
\(\text{=> ct muối là X2CO3}\)
\(\text{X2CO3 + 2HCl -> 2XCl + CO2 + H2O}\)
-> n X2CO3 = n CO2 = 0.2
Công thức tính khối lượng : M = m/n Hay 2X + 60 = 18 : 0.2
-> X =15
\(\text{Bài dựa vào bth tìm 2 nguyên tố có ntk gần 15 là đc}\)

Giả sử lượng kim loại tác dụng vừa đủ với 365g dd HCl 10%
\(n_{HCl}=\dfrac{365.10\%}{36,5}=1\left(mol\right)\)
PTHH: 2M + 2nHCl --> 2MCln + nH2
\(\dfrac{1}{n}\)<----1--------->\(\dfrac{1}{n}\)------>0,5
\(m_{MCl_n}=\dfrac{1}{n}\left(M_M+35,5n\right)\)
\(m_{dd\left(saupư\right)}=\dfrac{1}{n}.M_M+365-0,5.2=\dfrac{M_M}{n}+364\)
=> \(C\%\left(muối\right)=\dfrac{\dfrac{1}{n}\left(M_M+35,5n\right)}{\dfrac{M_M}{n}+364}.100\%=16,2\%\)
=> MM = 28n (g/mol)
Xét n = 1 => MM = 28(Loại)
Xét n = 2 => MM = 56(g/mol) => M là Fe(Sắt)
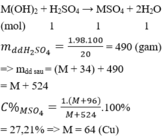
giả sử ban đầu có 98g dung dịch H2SO4. Gọi a là số mol của H2SO4
Ta có 10% = 98a.100%/98
=> số mol H2SO4: a = 0,1.
ptpu: MO + H2SO4 ---------------> MSO4 + H2O
0,1 0,1 0,1
Ta có: 11,8 = 0,1.(M + 98).100/[98+(16+M).0,1] => M=24 (Mg)