Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
MY = 18,8 Y chứa NO (3y) và H2 (2y) X chứa H+ và NO3- dư.
nNO = 0,26 mol
Bảo toàn khối lượng:
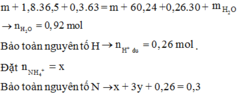
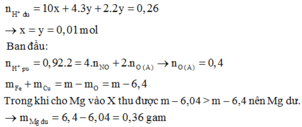
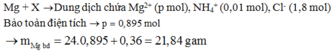

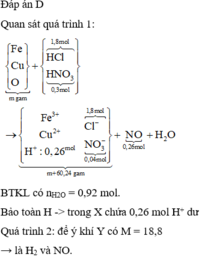
BTKL có nH2O = 0,92 mol. Bảo toàn H chứng tỏ trong X chứa 0,26 mol H+ dư như trên.
♦ Quá trình 2: để ý khí Y có M = 18,8 → là H2 và NO. Quan sát quá trình chính:
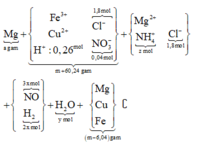
giải tỉ khối Y tìm tỉ lệ 2 khí NO : H2 là 3 : 2 rồi gọi các ẩn như sơ đồ:
• Ghép cụm: nH2O = 2nNO + 3nNH4 ⇄ y = 6x + 3z (1).
• bảo toàn nguyên tố N có: 3x + z = 0,04 mol (2).
• Bảo toàn nguyên tố H có: 4x + 2y + 4z = 0,26 mol (3)
Giải x = 0,01 mol; y = 0,09 mol; z = 0,01 mol
→ bảo toàn điện tích có nMg2+ = 0,895 mol.
► Chỉ cần BTKL cả sơ đồ có ngay và luôn giá trị yêu cầu a = 21,84 gam.
Đáp án D

Đáp án D
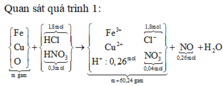
nHCl = 1,8 (mol); nHNO3 = 0,3 (mol); nNO = 0,26 (mol)
Quy đổi A thành Fe ( a) Cu ( b) ; O ( c) mol
Bảo toàn e ta có: 3a + 2b = 2c + 0,26.3 (1)
MY = 18,8 => 2 khí đó là H2 và NO. Vậy trong dd X phải có H+ dư
Dd X chứa: Fe3+ (a); Cu2+ (b); Cl- (1,8), NO3- ( 0,3 – 0,26 = 0,04); H+ dư = ( 2,1 – 0,26.4 -2c)
=> 56a + 64b + 35,5.1,8 + 62.0,04 + 1,06 – 2c = ( 56a + 64b + 16c) + 60,24
=> c = 0,4 (mol)
Vậy H+ dư = 0,26 (mol)
mFe+ Cu = mA – mO = m – 6,4. Nhưng khi cho Mg vào X thì thu được m – 6,04 gam chất rắn
=> Đã có Mg dư 6,4 – 6,04 = 0,36 gam. Vậy Fe3+, Cu2+ đã bị đẩy ra hết
MY = 18,8 (g/mol) dùng quy tắc đường chéo => nNO = 3/2 nH2.
Đặt nNO = 3x ; nH2 = 2x; nNH4+ = y (mol)
Có H2 thoát ra nên NO3- hết, bảo toàn N: 3x + y = 0,04 (3)
nH+ = 4.3x + 2.2x + 10y = 0,26 (4)
Từ ( 3) và (4) => x = y = 0,01 (mol). Từ (1) => 3a + 2b = 1,58
Bảo toàn e: 2nMg = 3a + 2b + 3.3x + 2.2x + 8y
=> nMg = (1,58 + 13. 0,01 + 8.0,01) : 2
= 0,895
=> mMg ban đầu = 0,895.24 + 0,36 = 21,84 (g) ≈ 22 (g)
Chú ý:
Tạo muối NH4+

Đáp án A
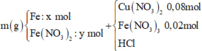
Y chứa 1 khí không màu hóa nâu trong không khí là NO
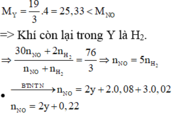
→ BTe 2 x = 2 . 0 , 08 + 0 , 02 + 2 . n H 2 + 3 . n N O = 0 , 18 + 17 5 . ( 2 y + 0 , 22 ) ( 1 )
Có khí H2 thoát ra chứng tỏ NO 3 - phản ứng hết, dung dịch X chứa FeCl2 và HCl dư.
Chất rắn không tan sau phản ứng là Cu:
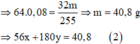
Từ (1) và (2) suy ra:
x = 0 , 6 y = 0 , 04 → BTNG . Fe n FeCl 2 = 0 , 6 + 0 , 04 + 0 , 02 = 0 , 66 mol
AgNO3 dư + X → 0,045 mol NO. 3 Fe 2 + + 4 H + + NO 3 - → 3 Fe 3 + + NO + 2 H 2 O 0 , 135 → 0 , 18 0 , 135 ← 0 , 045 mol
Fe2+ + Ag+ → Fe3+ + Ag
0,525 → 0,525 0,525 0,525 mol
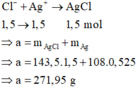
Gần nhất với giá trị 272,0

Đáp án C
Cho m gam hỗn hợp rắn gồm Fe, Fe(NO3)2 vào dung dịch chứa 0,08 mol Cu(NO3)2, 0,02 mol Fe(NO3)3 và HCl thu được dung dịch X và hỗn hợp hai khí không màu, có một khí hóa nâu trong không khí là NO
Ta có: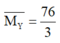 nên khí còn lại là H2 và tỉ lệ số mol NO: H2 là 5:1.
nên khí còn lại là H2 và tỉ lệ số mol NO: H2 là 5:1.
Cho AgNO3 dư vào dung dịch X thấy thoát ra 0,045 mol khí NO nên H+ dư trong X là 0,18 mol, do vậy X không chứa NO3-.
Mặt khác vì còn lại rắn không tan nên trong X chỉ chứa Fe2+ nên X chứa HCl dư và FeCl2.
Do còn H+ dư nên Fe hết ® rắn còn lại là Cu 0,08 mol
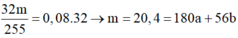
Gọi số mol Fe(NO3)2 là a mol; Fe là b mol và HCl là c mol
Bảo toàn N:![]()
![]()
Bảo toàn H:![]()
![]()
Bảo toàn nguyên tố Fe: ![]()
Giải hệ: a=0,04; b=0,6; c=1,5
Bảo toàn Cl:![]()
Bảo toàn e: ![]()
![]()
![]()

Đáp án A
Trong Z, đặt nCO = x; nCO2 = y ⇒ nZ = nCO ban đầu = x + y = 0,06 mol
mZ = 28x + 44y = 0,06 × 18 × 2 ||⇒ giải hệ có: x = y = 0,03 mol
CO + [O] → CO2 ⇒ nO mất đi = nCO2 = 0,03 mol. || nO/X = m64m64 mol; mKL = 0,75m(g).
nO/Y = (m64m64 – 0,03) mol || nNO3–/muối = 2nO + 3nNO = (m32m32 + 0,06) mol.
⇒ mmuối = 0,75m + 62 × (m32m32 + 0,06) = 3,08m ⇒ m ≈ 9,4777(g)

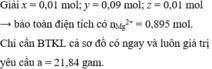
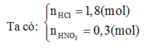
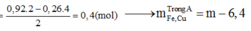

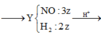
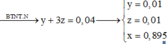

Đáp án C