

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(\left\{{}\begin{matrix}64.n_{Cu}+56.n_{Fe}=8,8\\\dfrac{n_{Cu}}{n_{Fe}}=\dfrac{1}{2}\end{matrix}\right.=>\left\{{}\begin{matrix}n_{Cu}=0,05\\n_{Fe}=0,1\end{matrix}\right.\)
nAgNO3 = 0,3.1,5 = 0,45(mol)
PTHH: Fe + 2AgNO3 --> Fe(NO3)2 + 2Ag\(\downarrow\)
_____0,1--->0,2---------->0,1---------->0,2
Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag\(\downarrow\)
0,05->0,1------------>0,05----->0,1
Fe(NO3)2 + AgNO3 --> Fe(NO3)3 + Ag\(\downarrow\)
___0,1----->0,1---------->0,1--------->0,1
=> nAg = 0,2 + 0,1 + 0,1 = 0,4 (mol)
=> mAg = 0,4.108 = 43,2 (g)

bn tính giùm mk m gam ag đk? tại mk tính ra ko thấy giống...
A. 43,2 gam B. 32,4 gam C. 35,6 gam D. 35,2 gam

Đáp án A
Các phản ứng xảy ra:
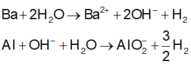
Vì thể tích H2 thu được ở hai trường hợp không bằng nhau nên khi hòa tan hỗn hợp vào nước dư thì còn một phần kim loại Al dư không tan.
Gọi n Ba = a n Al = b

Vậy m = mBa + mA1 = 24,5 (gam)

Giải thích:
Rắn không tan là Al dư => mAl dư = 1,35 (g)
nH2 = 2,24 : 22,4 = 0,1 (mol)
Gọi số mol Na = số mol Al pư = a (mol)
BT e ta có: nNa + 3nAl = 2nH2 => a + 3a = 2. 0,1
=> a = 0,05 (mol)
=> m = mNa + mAl pư + mAl dư = 0,05.23 + 0,05.27 + 1,35 = 3,85 (g)
Đáp án B