Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Phần 1: \(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\)
PTHH:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
a--------------------------->1,5a
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b--------------------------->b
\(\Rightarrow1,5a+b=0,06\left(1\right)\)
- Phần 2: Đặt hệ số tỉ lệ \(\dfrac{P_2}{P_1}=k\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=ak\left(mol\right)\\n_{Fe}=bk\left(mol\right)\end{matrix}\right.\Rightarrow ak+bk=0,15\left(2\right)\)
\(n_{H_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)
PTHH: \(2Al+2KOH+2H_2O\rightarrow2KAlO_2+3H_2\)
0,06<----------------------------------------0,09
\(\Rightarrow ak=0,06\left(3\right)\)
Từ \(\left(1\right),\left(2\right),\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,02\\b=0,03\\k=3\end{matrix}\right.\)
\(\Rightarrow m=\left(0,02.27+0,03.56\right)\left(3+1\right)=8,88\left(g\right)\)

Có V1 < V2 => khi X tác dụng với H2O thì Al còn dư.
Giả sử số mol 3 kim loại là: x, y, z.
K + H2O → KOH + ½ H2↑
x → x 0,5x
Al + KOH + H2O → KAlO2 + 1,5H2↑
x ← x→ 1,5x
→ 0,5x + 1,5x = 0,2 → x = 0,1
X tác dụng với KOH: 0,1 . 0,5 + 1,5y = 0,35 => y = 0,2
Khi cho X tác dụng với H2O còn dư Al => Y chứa Al dư và Fe
nAl dư = nAl ban đầu – nAl phản ứng = 0,2 – 0,1 = 0,1mol
=> 0,1 . 1,5 + z = 0,4 => z = 0,25mol
=> m = 23,3g

1)
$n_{H_2SO_4} = n_{H_2} = 0,45(mol)$
$\Rightarrow n_{BaSO_4} =n_{Ba(OH)_2} = n_{H_2SO_4} = 0,45(mol)$
Gọi $n_{Al} = 2a(mol) \to n_{Fe} =a (mol)$
Kết tủa F gồm :
$Fe(OH)_2 : a(mol)$
$Al(OH)_3 : b(mol) \Rightarrow n_{Ba(AlO_2)_2} = \dfrac{2a-b}{2}(mol)$
Nung F, thu được chất rắn gồm :
$Fe_2O_3 : 0,5a(mol)$
$Al_2O_3 : 0,5b(mol)$
$BaSO_4: 0,45(mol)$
$\Rightarrow 0,5a.160 + 0,5b.102 + 0,45.233 = 117,95(1)$
$n_{Ba(OH)_2} =n_{FeSO_4} + 3n_{Al_2(SO_4)_3} + n_{Ba(AlO_2)_2} = a + 3a + \dfrac{2a - b}{2} = 0,45(2)$
Từ (1)(2) suy ra a = 0,1 ; b = 0,1
$0,5n_A + 1,5n_{Al} + n_{Fe} = n_{H_2}$
$\Rightarrow n_A = 0,1(mol)$
Ta có : 0,1.A + 0,1.2.27 + 0,1.56 = 13,3
Suy ra: A = 23(Natri)
2)
$\%m_{Na} = \dfrac{0,1.23}{13,3}.100\% = 17,3\%$
$\%m_{Al} = \dfrac{0,2.27}{13,3}.100\% = 40,6\%$
$\%m_{Fe} = 100\% - 17,3\ - 40,6\% = 42,4\%$

Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{7,168}{22,4}=0,32\left(mol\right)\)
Pt : 2Al + 3H2SO4 → Al2(SO4)3 + 3H2\(|\)
2 3 1 3
a 0,32
Mg + H2SO4 → MgSO4 + H2\(|\)
1 1 1 1
b 0,32
Gọi a là số mol của Al
b là số mol của Mg
Theo đề ta có : mAl Mg+ m = 6,6 (g)
⇒ nAl . MAl + nMg . MMg = 6,6 g
27a + 24b = 6,6g (1)
Theo phương trình : 3a + 1b = 0,32 (2)
Từ (1),(2), ta có hệ phương trình :
27a + 24b = 6,6
3a + 1b = 0,32
⇒ \(\left\{{}\begin{matrix}a=0,024\\b=0,248\end{matrix}\right.\)
Khối lượng của nhôm
mAl = nAl . MAl
= 0,024 .27
= 0,648 (g)
Khối lượng của magie
mMg = nMg . MMg
= 0,248 . 24
= 5,952 (g)
Pt : H2 + CuO → (to) Cu + H2O\(|\)
1 1 1 1
0,32 0,32
Số mol của đồng
nCu = \(\dfrac{0,32.1}{1}=0,32\left(mol\right)\)
Khối lượng của đồng
mCu = nCu . MCu
= 0,32 . 64
= 20,48 (mol)
Chúc bạn học tốt


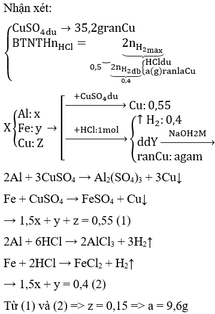
Fe + H2SO4 → FeSO4 + H2 (1)
2Al + 3H2SO4→Al2(SO4)3+3H2 (2)
nH2(1),(2)=10,08:22,4=0,45 mol
nH2(3)=6,72:22,4=0,3 mol
mặt khác ta có phương trình:2 KOH+2Al+2H2O→2KAlO2+3H2(3)
0,2mol<---------------------- 0,3mol
→ mAl= 0,2. 27=5,4 g
theo phương trình (2) có: nH2(2)=3/2 nAl=3/2 . 0,2 = 0,3 mol
→ nH2(1)=nH2(1),(2) - nH2(2)=0,45-0,3= 0,15 mol
theo pt (1) có: nFe=n H2(1)=0,15 mol→mFe=0,15. 56=8,4g