Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2 khí là NO và H2. Dễ tính NO = 0.1; H2 = 0.075
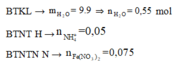
BTNT O →nZnO= 0.2
Đặt nMg = a; nAl =b.
Lập hệ → %nMg = 32%
Đáp án D

Chọn đáp án D.
Khí hóa nâu ngoài không khí là NO.


Gần với giá trị 30 nhất.

Đáp án D
Khí hóa nâu ngoài không khí là NO.
![]() => Khí còn lại có phân tử khối < 18 => Khí còn lại là H2.
=> Khí còn lại có phân tử khối < 18 => Khí còn lại là H2.
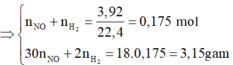
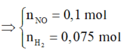
· Áp dụng bảo toàn khối lượng có:
![]()
![]()
Có:
![]()
=> Chứng tỏ có sản phẩm N H 4 + :
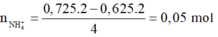
· Áp dụng bảo toàn N có: n F e ( N O 3 ) 2
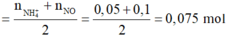
· Áp dụng bảo toàn nguyên tố O có:
![]()
![]()
· Đặt số mol của Mg, Al lần lượt là a, b
![]()
= 8,85
Vì có sản phẩm H2 tạo thành nên sau phản ứng Fe vẫn ở dạng Fe (II).
Áp dụng bảo toàn electron có:
![]()
![]()
Suy ra
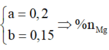
=> 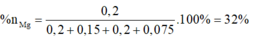
Gần với giá trị 30 nhất.

Đáp án C
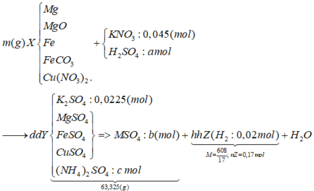

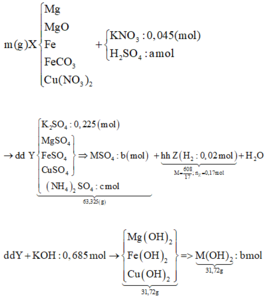
mZ = Mz. nZ = 608/17. 0,17 = 6,08 (g)
dd Y + 0,865 mol KOH => sẽ thu được duy nhất muối K2SO4
Bảo toàn nguyên tố K => nK2SO4 = ½( nKNO3 + nKOH ) = 0,91 (mol)
=> nSO42- = nK2SO4 = 0,455 (mol) = a
Ta có hệ 3 phương trình:

Bảo toàn nguyên tố H => nH2O = nH2SO4 – nH2 – 4n(NH4)2SO4 = 0,455 – 0,02 – 4.0,0125 = 0,385 (mol)
Bảo toàn khối lượng : mX + mKNO3 + mH2SO4 = mY + mZ + mH2O
=> mX = mY + mZ + mH2O - mKNO3 - mH2SO4
= 63,325 + 6,08 + 0,385.18 – 4,545 – 0,455.98
= 27,2 (g)

mZ = Mz. nZ = 608/17. 0,17 = 6,08 (g)
dd Y + 0,865 mol KOH => sẽ thu được duy nhất muối K2SO4
Bảo toàn nguyên tố K => nK2SO4 = ½( nKNO3 + nKOH ) = 0,91 (mol)
=> nSO42- = nK2SO4 = 0,455 (mol) = a
Ta có hệ 3 phương trình:
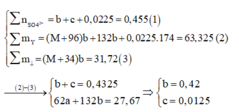
Bảo toàn nguyên tố H => nH2O = nH2SO4 – nH2 – 4n(NH4)2SO4 = 0,455 – 0,02 – 4.0,0125 = 0,385 (mol)
Bảo toàn khối lượng : mX + mKNO3 + mH2SO4 = mY + mZ + mH2O
=> mX = mY + mZ + mH2O - mKNO3 - mH2SO4
= 63,325 + 6,08 + 0,385.18 – 4,545 – 0,455.98
= 27,2 (g)
Đáp án C



Đáp án D
Dung dịch chứa
Bảo toàn H → nH2O = 0,16 – 0,01.2 = 0,14
x =
= 19,6