Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài tập vận dụng
VD1: Hoà tan hoàn toàn 7,45 gam KCI vào 200ml H2O thu đưoc dung dịch A. Tính nồng độ %, nồng độ mol/l
của dung dịch A.
VD2: Hoà tan hoàn toàn 0,2 mol NaOH vào 500ml H20 thu được dung dịch B. Tính nồng độ %, nồng độ mol/l
của dung dịch B.
VD3: Hoà tan hoàn toàn 2,8 gam KOH và 5,85 gam NaCl vào 600 ml H2O thu được dung dịch C. Tinh nồng độ
%, nồng độ mol/l của dung dịch C.
VD4: Hoà tan hoàn toàn 4,6 gam Na vào 100 gam H20 thu được dung dịch D. Tính nồng độ %, nồng độ mol/I
của dung dịch D.
VD5: Hoà tan hoàn toàn 2,74 gam Ba vào 200 gam H2O thu được dung dịch E. Tính nồng độ %, nồng độ mol/l
của dung dịch E.
VD6: Hoà tan hoàn toàn 5,85 gam K và 13,7 gam Ba vào 400ml H2O thu đưoc dung dịch F. Tính nồng đo %,
nồng đo mol/l của dung dịch F.
VD1:
\(n_{KCl}=\dfrac{7,45}{74,5}=0,1\left(mol\right)\\ V_{ddKCl}=V_{H_2O}=200\left(ml\right)=0,2\left(l\right)\\ C_{MddKCl}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)

\(n_{KCl}=\dfrac{7,45}{74,5}=0,1\left(mol\right)\)
PTHH: 2KCl + 2H2O → 2KOH + H2 + Cl2
Mol: 0,1 0,1
mdd sau pứ = 7,45 + 200 = 207,45 (g)
\(C\%_{ddKOH}=\dfrac{0,1.56.100\%}{207,45}=2,7\%\)
Vdd sau pứ = 1.200 = 200 (ml) = 0,2 (l)
\(C_{M_{ddKOH}}=\dfrac{0,1}{0,1}=1M\)

Số mol Na là:
nNa = m/M = 4,6/23 = 0,2 (mol)
PTHH: 2Na + 2H2O -> 2NaOH + H2↑
---------0,2-------0,2------0,2--------0,1
Khối lượng dd sau phản ứng là:
mddspư = mNa + mH2O - mH2 = 4,6 + 100 - 0,2 = 104,4 (g)
Nồng độ phần trăm dd NaOH sau phản ứng là:
C%NaOH = (mct/mddspư).100 = (0,2.40/104,4).100 ≃ 7,66 %
=>Cm =??

Chọn đáp án C
n C l 2 = 1 , 12 22 , 4 = 0,05 (mol); n N a O H d ư = 0,2.0,5 = 0,1 (mol)
C l 2 + 2NaOH → NaCl + NaClO + H 2 O
0,05 0,1 (mol)
=> n N a O H b đ = 0,1 + 0,1 = 0,2 (mol) => C M N a O H = = 1,0 (M)

\(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=5,6\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=16\left(g\right)\)
\(\Rightarrow n_{Fe}=2n_{Fe_2O_3}=0,2\left(mol\right)=n_{FeCl_3}\)
Lại có : \(n_{HCl}=2n_{H_2}+3n_{FeCl_3}=0,8\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=292\left(g\right)\)
\(\Rightarrow V=\dfrac{2920}{11}\left(ml\right)=\dfrac{73}{275}\left(l\right)\)
\(\Rightarrow C_{MFeCl_3}=\dfrac{0,2}{\dfrac{73}{275}}=\dfrac{55}{73}\left(M\right)\)
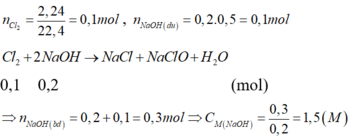
$n_{FeCl_2} = \dfrac{50,8}{127} = 0,4(mol)$
$V_{dd} = 200(ml) = 0,2(lít)$
$C_{M_{FeCl_2}} = \dfrac{0,4}{0,2} = 2M$