Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

R2O3+6HCl->2RCl3+3H2O
nHCl=0.3(mol)
->nR=0.05(mol)->MR2O3=8:0.05=160(g/mol)
->MR=(160-16*3):2=56(g/mol)->M là Fe
Bài 2
nH2=0.3(mol)
2X+2nHCl->2XCln+nH2(n là hóa trị của kim loại)
nX=0.6:n
+) n=1->MX=9(g/mol)->loại
+)n=2->MX=18(g/mol)->loại
+)n=3->MX=27(g/mol)->X là Al
Bài cuối bạn viết phương trình,chỉ phương trình Al+H2SO4 mới tạo khí thôi,vậy bạn tính được khối lượng nhôm,từ đó tính ra khối lượng nhôm oxit nhé,vì đang vội nên mình không giải giúp bạn được
Bài 3
nH2 = \(\frac{13,44}{22,4}\) = 0,6 mol
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 \(\uparrow\) (1)
0,4 <---- 0,6 <-------- 0,2 <------ 0,6 (mol)
Al2O3 + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2O (2)
a) %mAl = \(\frac{0,4.27}{31,2}\) . 100% = 34,62%
%mAl2O3 = 65,38%
b) nAl2O3 = \(\frac{31,2-0,4.27}{102}\) = 0,2 (mol) = nAl2(SO4)3
Theo pt(2) nH2SO4 = 3nAl2O3 = 0,6 (mol)
m dd H2SO4 = \(\frac{\left(0,6+0,6\right)98}{20\%}\) = 588(g)
c) m dd spư = 31,2 + 588 - 0,6 . 2 = 618 (g)
C%(Al2(SO4)3) = \(\frac{\left(0,2+0,2\right)342}{618}\) . 100% = 22,14%

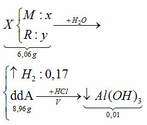
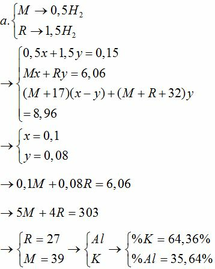
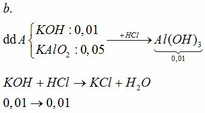
TH1: kết tủa Al(OH)3 chưa bị hòa tan
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,01 ←0,01
→ nHCl = 0,02
→ V = 0,02 (lít) = 20 (ml)
TH2: kết tủa Al(OH)3 bị hòa tan một phần
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,05 → 0,05 0,05
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,04` → 0,12
→ nHCl = 0,18 → V = 0,18 (l) = 180 (ml)
Vậy có 2 giá trị của V thỏa mãn là: 20 ml và 180 ml

Câu 1
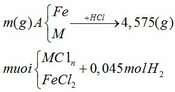
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
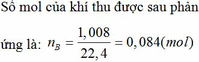
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
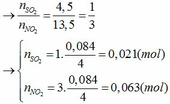
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
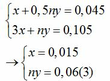
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

Goi nFe=x,nR=y.
56x+Ry=11,3.
X+y=0,3.
Tu 2 pt=>R<37,6.(1).
Thi ngiem 2.
=>nH2S04<0,4.
=>12<R.(2).
Tu 1 va 2=>
12<R<37,6.
R htri 2=>R la Mg.

a, Ta có: 24nMg + 56nFe = 12,8 (1)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,3\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
b, \(n_{HCl}=2n_{H_2}=0,8\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,8}{2}=0,4\left(l\right)\)
c, \(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
Theo PT: \(\left\{{}\begin{matrix}n_{Mg\left(OH\right)_2}=n_{MgCl_2}=n_{Mg}=0,3\left(mol\right)\\n_{Fe\left(OH\right)_2}=n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{\downarrow}=0,3.58+0,1.90=26,4\left(g\right)\)
a. Số gam mỗi kim loại trong hỗn hợp ban đầu:
Mg: 9,6 gamFe: 22,4 gamb. Thể tích dung dịch HCl 2M đã phản ứng: 0,2 lít
c. Khối lượng kết tủa thu được khi dd A tác dụng với dung dịch NaOH dư là 0,4 gam.
------------------------------------đấy



Gọi kim loại tương đương là M
nH2=0,4(mol)
M+2HCl--->MCl2+H2
0,4.....................0,4
nM=19,2/M=0,4
-->M=48
Vì Mmin<M<Mmax
-->R<48 (2)
nHCl=1(mol)
R+2HCl--->RCl2+H2(1)
''Cho Quì Tím Vào dd B Thấy Quì Tím Chuyển Thành Màu Đỏ ''
-->HCl dư
nR=19,2/R
Theo PT (1)
2*19,2/R < 1
-->R>38,4 (3)
(2)(3)-->Ca
b) tu2j làm tiếp nha