Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi hỗn hợp X gồm a mol Fe2O3 và b mol FeO. Do đó n F e 2 ( S O 4 ) 3 = a v à n F e S O 4 = b
Theo giả thiết a = 2b ⇒hỗn hợp X gồm 2b mol Fe2O3 và b mol FeO.
Trong 39,2 gam hỗn hợp X gồm 2b’ mol Fe2O3 và b’ mol FeO ⟹ 320b'+72b' = 39,2
⟹ b’ = 0,1 ⟹ nFeO = 0,1
![]()
⟹ V = 1,12 (lít)
Đáp án C

► Ăn mòn điện hóa học xảy ra khi thỏa đủ 3 điều kiện sau:
- Các điện cực phải khác nhau về bản chất.
- Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
- Các điện cực cùng tiếp xúc với dung dịch chất điện li.
(a) Ban đầu Zn bị ăn mòn hóa học: 3Zn + Fe2(SO4)3 → 3ZnSO4 + 2Fe
Fe sinh ra bám trực tiếp lên Zn ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
(b) Chỉ xảy ra ăn mòn hóa học: Fe + H2SO4 → FeSO4 + H2↑
(c) Ban đầu Zn bị ăn mòn hóa học: Zn + CuSO4 → ZnSO4 + Cu
Cu sinh ra bám trực tiếp lên Zn ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
(d) do H+/H2 > Cu2+/Cu ⇒ Zn tác dụng với Cu2+ trước: Zn + CuSO4 → ZnSO4 + Cu
Cu sinh ra bám trực tiếp lên Zn ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
⇒ (a), (c), (d) đúng
Đáp án A

Chọn đáp án A
► Ăn mòn điện hóa học xảy ra khi thỏa đủ 3 điều kiện sau:
- Các điện cực phải khác nhau về bản chất.
- Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
- Các điện cực cùng tiếp xúc với dung dịch chất điện li.
(a) Ban đầu Zn bị ăn mòn hóa học: 3Zn + Fe2(SO4)3 → 3ZnSO4 + 2Fe
Fe sinh ra bám trực tiếp lên Zn ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
(b) Chỉ xảy ra ăn mòn hóa học: Fe + H2SO4 → FeSO4 + H2↑
(c) Ban đầu Zn bị ăn mòn hóa học: Zn + CuSO4 → ZnSO4 + Cu
Cu sinh ra bám trực tiếp lên Zn ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
(d) do H+/H2 > Cu2+/Cu ⇒ Zn tác dụng với Cu2+ trước: Zn + CuSO4 → ZnSO4 + Cu
Cu sinh ra bám trực tiếp lên Zn ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
⇒ (a), (c), (d) đúng ⇒ chọn A.

Đáp án C
F e 2 S O 4 3 0 , 1 m o l F e S O 4 0 , 1 m o l C u S O 4 0 , 1 m o l + H 2 S → m g a m S C u S
nCuS = 0,1 mol; Theo bảo toàn electron: 2 × nS = 1 × nFe3+
→ nS = 0,1 × 2 : 2 = 0,1 mol.
→ m↓ = mS + mCuS = 0,1 × 32 + 0,1 × 96 = 12,8 gam

Đáp án B
Các dung dịch thoả mãn: Br2, KMnO4 trong H2SO4 loãng, NH3, K2Cr2O7 trong H2SO4 loãng.

Đáp án C
Ta có ![]()
![]()
=> mcác kim loại = ![]()
Chuỗi phản ứng: ![]()
![]()
![]()
![]()
=> nO oxi hóa FeO thành Fe2O3 =1,57 - 1,37 = 0,2 mol
Phản ứng: ![]()
= 0,2.2 = 0,4 mol
![]()
![]()

Cách 1: Quy đổi số oxi hóa
Sau toàn bộ quá trình, số oxi hóa cuối cùng của lưu huỳnh là +4 (trong SO2).
Giả sử S trong FeS2 và FeS đều là S + 4 .
Khi đó, có các quá trình nhường và nhận electron như sau:
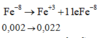
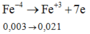
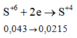

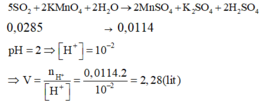
Đáp án D

Đáp án A.
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
X chứa CuSO4; FeSO4; H2SO4.