Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Na}=\dfrac{3,45}{23}=0,15\left(mol\right)\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,15 0,15 0,15 0,075
a. \(m_{H_2O}=0,15.18=2,7\left(g\right)\)
b. \(n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
0,075 0,075
Lập tỉ lệ: \(\dfrac{0,075}{2}< \dfrac{0,05}{1}\)
=> Lượng \(H_2\) sinh ra không đủ để pứ với 1,6 g \(O_2\)
\(m_{H_2O}=0,075.18=1,35\left(g\right)\)
a) \(n_{Na}=\dfrac{3,45}{23}=0,15\left(mol\right)\)
PTHH: 2Na + 2H2O ---> 2NaOH + H2
0,15---------------->0,15---->0,075
=> \(m_{\text{dd}NaOH}=\dfrac{0,15.40}{10\%}=60\left(g\right)\)
Ta có: \(m_{\text{dd}NaOH}=m_{Na}+m_{H_2O}-m_{H_2}\)
=> \(m=m_{H_2O}=60-3,45+0,075.2=56,7\left(g\right)\)
b) \(n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: \(2H_2+O_2\xrightarrow[]{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,075}{2}< \dfrac{0,05}{1}\Rightarrow O_2\) dư, H2 không đủ để đốt cháy hết
Theo PTHH: \(n_{H_2O}=n_{H_2}=0,075\left(mol\right)\)
=> \(m_{s\text{ản}.ph\text{ẩm}}=m_{H_2O}=0,075.18=1,35\left(g\right)\)

a)
\(n_{Na} = \dfrac{3,45}{23} = 0,15(mol)\\ 2Na + 2H_2O \to 2NaOH + H_2\\\)
Theo PTHH :
\(n_{NaOH} = n_{Na} = 0,15(mol)\\ m_{dung\ dịch\ NaOH} = \dfrac{0,15.40}{10\%} = 60(gam)\\ m_{H_2O\ đã\ dùng} = m = m_{dd\ NaOH} - m_{NaOH} = 60 -0,15.40 = 54(gam)\)
b)
\(n_{H_2} = \dfrac{n_{Na}}{2} = 0,075(mol)\\ n_{O_2} =\dfrac{1,6}{32} = 0,05(mol)\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
Ta thấy : \(\dfrac{n_{H_2}}{2} = 0,0375 < n_{O_2} \Rightarrow\) O2 dư. Do đó, lượng H2 sinh ra không đủ phản ứng hết với 1,6 gam oxi.
\(n_{H_2O} = n_{H_2} = 0,075(mol)\\ \Rightarrow m_{H_2O} = 0,075.18 = 1,35(gam)\)

a) 2Na+2H2O--->2NaOH+H2
n Na=3,45/23=0,15(mol)
n NaOH=n Na=0,15(mol)
m NaOH=0,15.40=6(g)
m dd NaOH=6.100/10=60(g)
m nước=m dd-m NaOH=60-6=54(g)
b) 2H2+O2--->2H2O
n H2=1/2n Na=0,075(mol)
n O2=1,6/32=00,05(mol)
--->O2 dư...Lượng H2 k đủ phản ứng với O2
n H2O=n H2=0,075(mol)
m H2O=0,075.18=1,35(g)

Bài Đầu tiên
a, PTHH : 2Na + 2H2O -> 2NaOH + H2
nNa = \(\dfrac{3,45}{23}=0,15\left(mol\right)\)
Ta có , mdung dịch = m + 3,45 (g)
mdung dịch bazo = mNaOH ( cái này khác với dung dịch sau phản ứng nhé )
Theo PTHH , nNa= nNaOH= 0,15 (mol)
=> mNaOH = 0,15 . 40 =6(g)
Theo bài ra ta có hệ phương trình sau :
\(\dfrac{6}{m+3,45}.100\%=10\%\Leftrightarrow6=0,1m+0,345\)
=> m = 56,55 (g)
b, nH2= 0,15 /2 = 0,075 (mol)
PTHH : 2H2 + O2 -> 2H2O
nO2=1,6/32 =0,05 (mol)
Vì 0,075/2 < 0,05 => Oxi dư => H2 thiếu
=> lượng Hidro không đủ
Bài 5:
mHCl = \(\dfrac{3,65\times100}{100}=3,65\left(g\right)\)
\(\Rightarrow n_{HCl}=\dfrac{3,65}{36,5}=0,1\)mol
Pt: 2Al + 6HCl --> 2AlCl3 + 3H2
.....Fe + 2HCl --> FeCl2 + H2
.....Mg + 2HCl --> MgCl2 + H2
Theo pt ta có: nH2 = \(\dfrac{1}{2}\)nHCl = \(\dfrac{1}{2}.0,1=0,05\) mol
=> VH2 = 0,05 . 22,4 = 1,12 (lít)
mmuối khan = mkim loại + mgốc axit = 1,34 + 0,1 . 35,5 = 4,89 (g)

a, \(n_{Na}=\dfrac{3,45}{23}=0,15\left(mol\right)\)
PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Theo PT: \(n_{NaOH}=n_{Na}=0,15\left(mol\right)\Rightarrow C_{M_{NaOH}}=\dfrac{0,15}{0,2}=0,75\left(M\right)\)
b, \(n_{H_2}=\dfrac{1}{2}n_{Na}=0,075\left(mol\right)\)
\(n_{O_2}=\dfrac{0,96}{32}=0,03\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,075}{2}>\dfrac{0,03}{1}\), ta được H2 dư.
Theo PT: \(n_{H_2O}=2n_{O_2}=0,06\left(mol\right)\Rightarrow m_{H_2O}=0,06.18=1,08\left(g\right)\)

Số mol của nhôm
nAl = \(\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
a) Pt : 2Al + 6HCl → 2AlCl3 + 3H2\(|\)
2 6 2 2
0,2 0,6 0,2
b) Số mol của khí hidro
nH2= \(\dfrac{0,2.2}{2}=0,2\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,2 . 22,4
= 4,48 (l)
c) Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,2.6}{2}=0,6\left(mol\right)\)
250ml = 0,25l
Nồng độ mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}=\dfrac{0,6}{0,25}=2,4\left(M\right)\)
Chúc bạn học tốt

Zn+2HCl->Zncl2+H2
0,4----0,8----0,4----0,4
n Zn=0,4 mol
VH2=0,4.22,4=8,96l
m ZnCl2=0,4.136=54,4g
2H2+O2-to>2H2O
0,4------0,2----0,4
n O2=0,2 mol
=>pứ hết
=>m H2O=0,4.18=7,2g
a.b.\(n_{Zn}=\dfrac{26}{65}=0,4mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,4 0,4 0,4 ( mol )
\(m_{ZnCl_2}=0,4.136=54,4g\)
\(V_{H_2}=0,4.22,4=8,96l\)
c.\(n_{O_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,4 = 0,2 ( mol )
0,4 0,2 0,4 ( mol )
\(m_{H_2O}=0,4.18=7,2g\)

a)
Khối lượng của dung dịch:
\(m_{dd}=m_{ct}+m_{dm}=20+180=200\left(g\right)\)
Nồng độ phần trăm của dung dịch:
\(C\%=\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{20}{200}.100\%=10\%\)
b) đề sai nha bạn
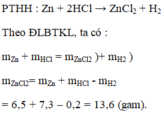
a) PTHH: 2Na + 2H2O \(\rightarrow\) 2NaOH + H2\(\uparrow\)(1)
nNa = \(\frac{3,45}{23}=0,15\left(mol\right)\)
Theo PT(1): n\(H_2O\) = nNa = 0,15 (mol)
=> m\(H_2O\) = 0,15.18 = 2,7 (g) = m
b) PTHH: 2H2 + O2 \(\underrightarrow{t^o}\) 2H2O(2)
n\(O_2\) = \(\frac{1,6}{32}=0,05\left(mol\right)\)
Theo PT(1): n\(H_2\) = \(\frac{1}{2}n_{Na}\) = \(\frac{1}{2}.0,15=0,075\left(mol\right)\)= n\(H_2\)(2)
Ta có tỉ lệ: \(\frac{n_{H_2}}{2}=\frac{0,075}{2}=0,0375< \frac{n_{O_2}}{1}=0,05\)
=> H2 hết, O2 dư => lượng hidro sinh ra đủ để pứ với 1,6g oxi
=> Tính số mol các chất cần tìm theo H2
Theo PT(2): n\(H_2O\) = n\(H_2\) = 0,075(mol)
=> m\(H_2O\) = 0,075.18 = 1,35(g)
a) PTHH: \(2Na+2H_2O\rightarrow2NaOH+H_2\uparrow\)
\(n_{Na}=\frac{3,45}{23}=0,15\left(mol\right)\)
Theo pt \(\Rightarrow n_{NaOH}=0,15\cdot40=6\left(mol\right)\)
\(\Rightarrow\) mdd NaOH = \(\frac{6\cdot100\%}{10\%}=60\left(g\right)\)
Áp dụng ĐLBTKL:
\(\frac{6}{m+3,45}\cdot100\%=10\%\Leftrightarrow6=0,1m+3,45\)
\(\Rightarrow m=56,7\left(g\right)\)
b) PTHH: \(2H_2+O_2\rightarrow2H_2O\)
\(n_{H_2}=\frac{0,15}{2}=0,075\left(mol\right)\)
\(n_{O_2}=\frac{1,6}{32}=0,05\left(mol\right)\)
Lập tỉ lệ : \(\frac{0,075}{2}< 0,05\)
\(\Rightarrow\) O2 dư, kết luận lượng H2 sinh ra không đủ để phản ứng với 1,6g O2.
Theo pt \(\Rightarrow n_{H_2O}=n_{H_2}=0,075\left(mol\right)\)
\(\Rightarrow m_{H_2O}=0,075\cdot18=1,35\left(g\right)\)