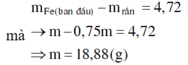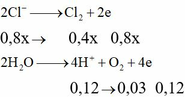Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
nFe3+ = 0,08 (mol); H+ còn dư
Dd Y gồm: FeCl3 , FeCl2, CuCl2, HCl dư
Qúa trình điện phân dd Y
Catôt (Fe3+, Fe2+, Cu2+, H+) Anốt (Cl-)
Fe3+ +1e → Fe2+ 2Cl- + 2e → Cl2
0,08 → 0,08
Cu 2+ + 2e → Cu
x → 2x
2H+ + 2e → H2
Khi catốt có khí thì ngừng => chưa xảy ra phản ứng điện phân H+
Gọi nCuCl2 = x (mol)
=> ne trao đổi = 0,08 + 2x = 2nCl2
mdd giảm = mCu + mCl2 = 64x + 71( 0,04 + x) = 13,64
=> x = 0,08 (mol)
Gọi số mol Fe3O4 và Fe2O3 lần lượt là a và b mol
BTKL: 232a + 160b + 0,08.64 = 27,2 (1)
2Fe3+ + Cu → Fe2+ + Cu2+
=> nFe3+ sau = nFe3+ ban đầu – nCu
<=> 2a + 2b – 2.0,08 = 0,08 (2)
Từ (1) và (2) => a = 0,04 ; b = 0,08 mol
BTNT Fe: nFe2+ = nFe bđ – nFe3+ sau = 0,2 mol
nH+ dư = nHCl dư = nHCl bđ – 3nFeCl3 – 2nFeCl2 – 2nCuCl2 = 0,1 mol
Sau điện phân thì nFe2+ = 0,28 (mol); nCl- = 0,66 (mol); nH+ = 0,1 (mol)
Khi cho AgNO3 vào:
3Fe2+ + 4H+ + NO3- →3Fe3+ + NO + H2O
0,075← 0,1
Ag+ + Fe2+ → Fe3+ + Ag↓
(0,28 – 0,075)→ 0,205
Ag+ + Cl- → AgCl↓
0,66 → 0,66
m↓ = mAg + mAgCl = 0,205.108 + 0,66.143,5 = 116,85(g)

Quy hỗn hợp thành Fe2O3, FeO và CuO với số mol lần lượt là a b và c.
Ta có sơ đồ phản ứng:
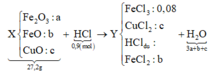
Khi điện phân dung dịch Y đến khi catot thoát khí ⇒ FeCl3 và CuCl2 đã bị điện phân hết.
⇒ mGiảm = nFeCl3×35,5 + nCuCl2×135 = 13,64 gam Û nCuCl2 = 0,08 mol.

●Tóm lại sau điện phân dung dịch chứa: nFeCl2 = 0,28 mol và nHCl = 0,1 mol.
Cho dung dịch sau điện phân + AgNO3 ⇒ 3Fe2+ + 4H+ + NO3– → Fe3+ + NO + 2H2O.
⇒ nFe2+ bị mất đi = 0,1 × 3 ÷ 4 = 0,075 mol
⇒ nFe2+ còn lại = 0,28 – 0,075 = 0,205 mol.
⇒ nAg = nFe2+ = 0,205 mol
nAgCl = nCl– = 0,28×2 + 0,1 = mol.
⇒ m↓ = mAg + mAgCl = 0,205×108 + 0,66×143,5 = 116,85
Đáp án A

Chọn B.
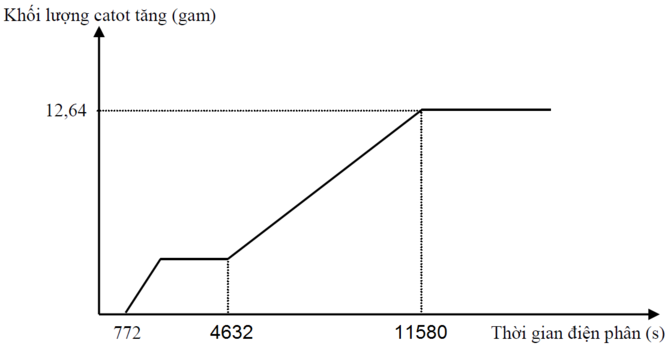
Dung dịch X chứa H+(x mol), Fe2+ (y mol), Fe3+ (z mol), Cu2+ (t mol), Cl- (0,6 mol)
![]()
Tại thời điểm t1 = 772 (s): Fe3+ điện phân hết chuyển thành Fe2+ Þ ne (1) = z
Tại thời điểm t2 = 4632 (s): Cu2+, H+ điện phân hết Þ ne (2) = x + z + 2t
Tại thời điểm t3 = 11580 (s): Fe2+ điện phân hết Þ ne (3) = x + 2y + 3z + 2t và 56(y + z) + 64t = 12,64 (2)
+ Với t2 = 6t1 Þ x + z + 2t = 6z (3)
+ Với t3 = 15t1 Þ x + 2y + 3z + 2t = 15z. Thay (1) vào Þ z = 0,04
Từ (1), (2), (3) suy ra: x = 0,12 ; y = 0,14 ; t = 0,04
Khi cho AgNO3 đến dư vào X thì:
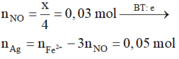
Kết tủa thu được là AgCl (0,6 mol) và Ag (0,03 mol) Þ m = 91,5 (g)

Chọn A.
Khi cho Fe tác dụng với Y thì hỗn hợp rắn gồm Cu và Fe dư.
với nFe pư =
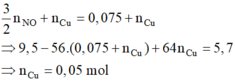
và n H + = 4 n NO = 0 , 2 mol . Dung dịch Y gồm Cu2+ (0,05); H+ (0,2); Na+ (0,5V) và NO3- (2V)
→ BTDT V = 0,2. Dung dịch ban đầu gồm Cu(NO3)2 (0,2 mol) và NaCl (0,1 mol)
Khối lượng dung dịch giảm: m = 64.(0,2 - 0,05) + 71.0,05 + 32.0,05 = 14,75 (g)

Đáp án A
nCu2+ = 1,2a ; nCl = 0,8a
nNO = 0,03 mol => nH+ = nHNO3 = 0,12 mol
nFe = 0,2 mol
Cu(NO3)2 + 2NaCl -> Cu + Cl2 + 2NaNO3
0,4a 0,8a 0,4a 0,4a
Cu(NO3)2 + H2O -> Cu + 0,5O2 + 2HNO3
0,06 0,06 0,03 0,12
mgiảm = 64(0,4a + 0,06) + 71.0,4a + 32.0,03 = 10,2
=> a = 0,1
=> nCu2+ dư = 1,2a – 0,4a – 0,06 = 0,02 mol
Bảo toàn electron : 2nFe = 3nNO (Vì lượng Fe quá lớn so với NO sinh ra => Fe chỉ tạo Fe2+)
=> nFe pứ = 0,045 mol
Fe + Cu2+ -> Fe2+ + Cu
0,02 0,02 -> 0,02
=> chất rắn gồm : 0,135 mol Fe và 0,02 mol Cu
=> mrắn = 8,84g

nCu2+ = 1,2a ; nCl = 0,8a
nNO = 0,03 mol => nH+ = nHNO3 = 0,12 mol
nFe = 0,2 mol
Cu(NO3)2 + 2NaCl → Cu + Cl2 + 2NaNO3
0,4a 0,8a 0,4a 0,4a
Cu(NO3)2 + H2O → Cu + 0,5O2 + 2HNO3
0,06 0,06 0,03 0,12
mgiảm = 64(0,4a + 0,06) + 71.0,4a + 32.0,03 = 10,2
=> a = 0,1
=> nCu2+ dư = 1,2a – 0,4a – 0,06 = 0,02 mol
Bảo toàn electron : 2nFe = 3nNO (Vì lượng Fe quá lớn so với NO sinh ra => Fe chỉ tạo Fe2+)
=> nFe pứ = 0,045 mol
Fe + Cu2+ → Fe2+ + Cu
0,02 0,02 → 0,02
=> chất rắn gồm : 0,135 mol Fe và 0,02 mol Cu
=> mrắn = 8,84g
Đáp án A

Chọn A
Ta có n e ( trao đổi ) = It 96500 = 0 , 34 mol . Các quá trình điện phân diễn ra như sau:
| Tại catot |
Tại anot |
| Cu2+ + 2e → Cu a mol 2a mol → a mol
|
2Cl- → Cl2 + 2e 0,18 mol 0,09 mol 0,18 mol H2O → 4H+ + O2 + 4e 4b mol ← b mol → 4b mol |
Xét khối lượng giảm sau điện phân ta có:
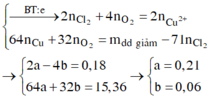
Dung dịch sau điện phân chứa: Na+, H+ (0,24 mol) và NO3- (0,5 mol) và Cu2+ (0,04 mol)
Khi cho dung dịch sau điện phân tác dụng với Fe dư thì: