Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt $n_{NO}=2a(mol);n_{NO_2}=a(mol)$
Bảo toàn e ta có: $6a+a=0,1.3+0,25.3\Rightarrow a=0,15(mol)$
Do đó $n_{A}=0,15.3=0,45(mol)\Rightarrow V_A=10,08(l)$
tham khảo trong:
https://moon.vn/hoi-dap/hoa-tan-hoan-toan-hon-hop-gom-01-mol-fe-va-025-mol-al-vao-dung-dich-hno3-du-thu-duoc-530914

Đáp án C.
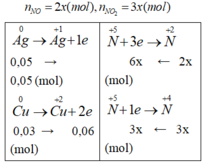
9x = 0,11; x= 11/900 => V = 5x.22,4 = 1,368 (l)

a, BTNT N, có: nHNO3 (bị khử) = nNO + 2NN2O = 0,4 + 2.0,1 = 0,6 (mol)
b, Giả sử: nAl = mMg = x (mol)
Các quá trình:
\(Al^0\rightarrow Al^{+3}+3e\)
x___________ 3x (mol)
\(Mg^0\rightarrow Mg^{+2}+2e\)
x_____________ 2x (mol)
\(N^{+5}+3e\rightarrow N^{+2}\)
_____ 1,2 __ 0,4 (mol)
\(2N^{+5}+8e\rightarrow N_2^{+1}\)
_______0,8__0,1 (mol)
Theo ĐLBT mol e, có: 3x + 2x = 1,2 + 0,8 ⇒ x = 0,4 (mol)
⇒ nAl = nMg = 0,4 (mol)
BTNT Al, có: nAl(NO3)3 = nAl = 0,4 (mol)
BTNT Mg, có: nMg(NO3)2 = nMg = 0,4 (mol)
BTNT N, có: nHNO3 (pư) = 3nAl(NO3)3 + 2nMg(NO3)2 + nNO + 2nN2O
= 3.0,4 + 2.0,4 + 0,4 + 2.0,1 = 2,6 (mol)
c, m = mAl + mMg = 0,4.27 + 0,4.24 = 20,4 (g)
Bạn tham khảo nhé!

Ta có: \(n_{NO}+n_{NO_2}+n_{N_2}=\dfrac{22,4}{22,4}=1\left(mol\right)\left(1\right)\)
Mà: mX = 35,8 (g)
\(\Rightarrow30n_{NO}+46n_{NO_2}+28n_{N_2}=35,8\left(2\right)\)
Có: \(n_{Al}=\dfrac{32,4}{27}=1,2\left(mol\right)\)
\(n_{Cu}=\dfrac{22,4}{64}=0,35\left(mol\right)\)
BT e, có: 3nNO + nNO2 + 10nN2 = 3nAl + 2nCu = 4,3 (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}n_{NO}=0,3\left(mol\right)\\n_{NO_2}=0,4\left(mol\right)\\n_{N_2}=0,3\left(mol\right)\end{matrix}\right.\)
⇒ nHNO3 = 4nNO + 2nNO2 + 12nN2 = 5,6 (mol)

Coi \(n_{Cu} = n_{FeO} = 1(mol)\\ n_{Fe} = x(mol)\)
Bảo toàn electron cho quá trình 1:
\(2n_{Fe} + 2n_{Cu} = 3n_{NO}\)
⇒ 2x + 2 = 3a(1)
Y gồm \(Cu(NO_3)_2,Fe(NO_3)_2\)
Bảo toàn electron cho quá trình 2 :
\(n_{Fe(NO_3)_2} = x + 1 = 3n_{NO}\)
⇒ x + 1 = 3b(2)
Lấy (1) : (2), ta có \(\dfrac{2x + 2}{x + 1} =\dfrac{3a}{3b} \Rightarrow \dfrac{a}{b} = 2\)

Gọi số mol của kim loại Fe có trong hỗn hợp trên là \(x\) (mol) \(\Rightarrow n_{Cu}=2x\left(mol\right)\) (Vì \(n_{Fe}:n_{Cu}=1:2\))
Theo đề, ta có: mhỗn hợp = \(m_{Fe}+m_{Cu}=56x+64.2x=18,4\left(g\right)\)
\(\Leftrightarrow x=0,1\left(mol\right)\)
Vậy, trong hỗn hợp ban đầu có 0,1 (mol) Fe và 0,2 (mol) Cu.
PTHH:
\(Fe+6HNO_3\rightarrow Fe\left(NO_3\right)_3+3NO_2+3H_2O\left(1\right)\)
Số mol: 0,1 mol -------------------------------> 0,3 mol
\(Cu+4HNO_3\rightarrow Cu\left(NO_3\right)_2+2NO_2+2H_2O\left(2\right)\)
Số mol: 0,2 mol ---------------------------------> 0,4 mol
Theo (1), ta có: \(n_{NO_2\left(1\right)}=3n_{Fe}=3.0,1=0,3\left(mol\right)\)
Theo (2), ta có: \(n_{NO_2\left(2\right)}=2.n_{Cu}=2.0,2=0,4\left(mol\right)\)
\(\Rightarrow\sum n_{NO_2}=n_{NO_2\left(1\right)}+n_{NO_2\left(2\right)}=0,3+0,4=0,7\left(mol\right)\)
\(\Rightarrow V_{NO_2}=0,7.22,4=15,68\left(l\right)\)

