Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Sửa đề: `3,7285 -> 3,7185` và `2,075 -> 20,75`
\(n_{H_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
Đặt CT chung của 2 kim loại kiềm là R
\(2R+2H_2O\rightarrow2ROH+H_2\)
0,3<-------------0,3<-----0,15
\(ROH+HCl\rightarrow RCl+H_2O\)
0,3------------->0,3
\(\Rightarrow M_{RCl}=\dfrac{20,75}{0,3}=\dfrac{415}{6}\left(g/mol\right)\\ \Rightarrow M_R=\dfrac{415}{6}-35,5=\dfrac{101}{3}\left(g/mol\right)\)
`=>` 2 kim loại là Na và K
b) Đặt \(\left\{{}\begin{matrix}n_{Na}=a\left(mol\right)\\n_K=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a+b=0,3\\58,5+74,5=20,75\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na}=0,1.23=2,3\left(g\right)\\m_K=0,2.39=7,8\left(g\right)\end{matrix}\right.\)

Đổi 896 cm3 = 0,896 lít
=> nH2 = 0,896 / 22,4 = 0,04 mol
Đặt công thức hóa học chung của 2 kim loại kiềm thổ là \(\overline{M}\)
PTHH: \(2\overline{M}+2H_2O\rightarrow2\overline{M}OH+H_2\)
0,08.........................................0,04
=> \(M_{\overline{M}}=\frac{2,16}{0,08}=27\left(\frac{g}{mol}\right)\)
=> Hai kim loại kiềm đó là Na và K
b/ Gọi số mol K, Na lần lượt là x, y (mol)
PTHH
2K + 2H2O ===> 2KOH + H2
x.............................................0,5x
2Na + 2H2O ===> 2NaOH + H2
y ................................................y
Theo đề ra, ta có hệ phương trình:
\(\begin{cases}39x+23y=2,16\\0,5x+0,5y=0,04\end{cases}\)
=> \(\begin{cases}x=0,02\\y=0,06\end{cases}\)
=> mNa = 0,06 x 23 = 1,38 gam
mK = 0,02 x 39 = 0,78 gam
=> %mNa = \(\frac{1,38}{2,16}.100\%=63,89\%\)
%mK = 100% - 63,89% = 36,11%
c/

a)
Gọi công thức chung của 2 kim loại là X , X thuộc nhóm IIA nên X có hóa trị II
Ta có PTHH : X + 2HCl → XCl2 + H2
nH2 = \(\dfrac{3,36}{22,4}\)= 0,15 mol = nX
=> Mx = \(\dfrac{4,4}{0,15}\) = 29,3 (g/mol)
Hai kim loại thuộc 2 chu kỳ liên tiếp => 2 kim loại đó là Mg(24) và Ca(40)
Đặt số mol của Mg là x mol và Ca là y mol ta có hệ pt
\(\left\{{}\begin{matrix}24x+40y=4,4\\x+y=0,15\end{matrix}\right.\)=> x = 0,1 , y = 0,05
%mMg = \(\dfrac{0,1.24}{4,4}\).100 = 54,54% , %mCa = 100 - 54,54 = 45,46%
b) Khối lượng dung dịch sau phản ứng = mKim loại + mHCl - mH2
mdd = 4,4 + 200 - 0,15.2 = 204,1 gam
C%MgCl2 = \(\dfrac{0,1.95}{204,1}\).100 = 4,65%
C%CaCl2 = \(\dfrac{0,05.111}{204,1}\).100 = 2,72%

gọi công thức chung của 2 kim loại kiềm là M
2M+ 2H2O-> 2MOH+ H2
0,1 <-1,12/22,4
-> Mtrung bình của M là: 3,1/ 0,1= 31
=> M1< 31< M2
mà 2 kim loại kiềm thuộc 2 chu kì liên tiếp nhau
=> M1= 23, M2= 39
=> 2 kim loại cần tìm là na và k
2na+ 2h2o-> 2naoh+ h2
a-> 0,5a
2k+ 2h2o-> 2koh+ h2
b-> 0,5b
đặt nna=a, nk=b ta có hệ
23a+39b= 3,1
a+b= 0,05/0,5
=> a=0,05
b=0,05
=> %mk= 0,05*39/3,1*100= 62,9%
=> %mna=100-62,9=37,1%

Đây là VD cho dạng bài tương tự nhé! Bạn xem thử!
https://hoc24.vn/hoi-dap/tim-kiem?id=237172646178&q=Cho+4,4g+h%E1%BB%97n+h%E1%BB%A3p+2+kim+lo%E1%BA%A1i+nh%C3%B3m+IIA+thu%E1%BB%99c+hai+chu+k%C3%AC+li%C3%AAn+ti%E1%BA%BFp+t%C3%A1c+d%E1%BB%A5ng+v%E1%BB%9Bi+dung+d%E1%BB%8Bch+HCl+d%C6%B0+thu+%C4%91%C6%B0%E1%BB%A3c+3,36+l%C3%ADt+H2+(%C4%91ktc).+a)+X%C3%A1c+%C4%91%E1%BB%8Bnh+t%C3%AAn+kim+lo%E1%BA%A1i.+b)+T%C3%ADnh+C%+c%E1%BB%A7a+dung+d%E1%BB%8Bch+thu+%C4%91%C6%B0%E1%BB%A3c.

X+ HCl -> XCl + 1/2 H2
nH2=0,25(mol)
-> nHCl(ban đầu)= (2.0,25) . 110%=0,55(mol)
VddHCl= 0,55/2=0,275(l)=275(ml)
=>mddHCl=275.1,2=330(g)
mddA=mX+ mddHCl -mH2= 14,7+330-0,25.2=344,2(g)



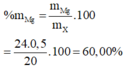

Gọi M là khối lượng mol trung bình của 2 nguyên tố
nH2=6.72/22.4=0.3 mol
M + H2O --> MOH + 1/2 H2
0.6mol---------------------0.3mol
-> M=20.2/0.3=67.3333
-->M1<67.33<M2
mà 2 kim loại này thuộc hai chu kì liên tiếp nhau
--> Kim loại đó là KI và Rb